Deskriptor (Chemie)

Als Deskriptor bezeichnet man in der chemischen Nomenklatur ein Präfix vor dem systematischen Substanznamen, der die Konfiguration oder die Stereochemie des Moleküls beschreibt.[1] Einige Deskriptoren sind nur noch von chemiehistorischer Bedeutung und sollen in aktuellen Publikationen nicht mehr verwendet werden, da sie in den gültigen Empfehlungen der IUPAC nicht mehr berücksichtigt werden.
Häufig werden Deskriptoren in Kombination mit Lokanten verwendet, um eine chemische Struktur eindeutig zu benennen.
Bei der alphabetischen Sortierung werden die in der Regel am Anfang des systematischen Namens stehenden Deskriptoren nicht berücksichtigt.
Konfigurationsdeskriptoren
[Bearbeiten | Quelltext bearbeiten]cis-, trans-
[Bearbeiten | Quelltext bearbeiten]

Die Deskriptoren cis- (lat. diesseits)[2] und trans- (lat. über ... hin(aus), jenseits)[3] werden bei der Beschreibung chemischer Konfigurationen in verschiedenen Zusammenhängen genutzt.[4][5]
In der organischen Strukturchemie kann mit cis- und trans- die Konfiguration einer Doppelbindung beschrieben werden, sofern diese ein einfaches Substitutionsmuster mit lediglich zwei Resten aufweist. Auch die Stellung zweier Reste zueinander, die in einem Ringsystem oder einem größeren Molekül an unterschiedlichen Stellen lokalisiert sind, kann mit cis- und trans- beschrieben werden, sofern die Struktur bezüglich der Konfiguration starr ist und keine einfache Inversion zulässt.
In der anorganischen Komplexchemie werden die Deskriptoren cis- und trans- zur Kennzeichnung der Stellungsisomere in oktaedrischen Komplexen mit A2B4X-Konfiguration oder quadratisch-planaren Komplexen mit A2B2X-Konfiguration verwendet.
-
Oktaedrischer Komplex mit cis-Konfiguration
-
Oktaedrischer Komplex mit trans-Konfiguration
-
Quadratisch-planarer Komplex: Cisplatin
Typographisch werden cis- und trans- stets klein und kursiv geschrieben.
An höher substituierten Doppelbindungen ist die cis-/trans-Nomenklatur nicht eindeutig, weshalb in diesen Fällen die E-/Z-Nomenklatur empfohlen wird.[6]

Mit s-cis und s-trans kann die Konfiguration einer Einfachbindung (s- steht für „single bond“, Einfachbindung) zwischen zwei Doppelbindungen (beispielsweise von Dienen) beschrieben werden. Liegen beide Doppelbindungen auf derselben Seite der Einfachbindung, handelt es sich um die s-cis-Konfiguration, bei gegenüberliegenden Doppelbindungen liegt eine s-trans-Konfiguration vor. Auch die Bezeichnungen synperiplanar und antiperiplanar werden hierfür genutzt. Diese sind jedoch nicht identisch mit s-cis bzw. s-trans, sondern vom Substitutionsmuster an den Doppelbindungen abhängig. In der Praxis können die Einfachbindungsisomere aufgrund der niedrigen Aktivierungsenergie für die Umwandlung kaum getrennt werden (3,9 kcal/mol für 1,3-Butadien) und spielen daher nur eine Rolle bei Reaktionen, die zum Ablaufen eine bestimmte Konfiguration benötigen wie beispielsweise der Diels-Alder-Reaktion.[7]
E-, Z-
[Bearbeiten | Quelltext bearbeiten]
Die Deskriptoren E- (von entgegen) und Z- (von zusammen) werden verwendet, um eine eindeutige Beschreibung des Substitutionsmusters an Alkenen, Cumulenen oder anderen Doppelbindungssystemen wie Oximen zu ermöglichen.[8] Für die Zuschreibung von E oder Z ist entscheidend, in welchem Stellungsverhältnis die beiden nach der CIP-Nomenklatur am höchsten priorisierten Substituenten auf jeder Seite des Doppelbindungssystems zueinander stehen. Die E/Z-Nomenklatur kann bei beliebigen Doppelbindungssystemen (auch mit Heteroatomen) angewandt werden. Für substituierte Ringsysteme soll nicht die E-/Z-Nomenklatur, sondern die cis/trans-Nomenklatur verwendet werden.[6]
Die Deskriptoren (E)- und (Z)- werden stets groß und kursiv geschrieben, sie sind von runden Klammern umgeben, die ebenso wie zusätzliche Lokanten oder Kommata normal gesetzt werden.
o-, m-, p-
[Bearbeiten | Quelltext bearbeiten]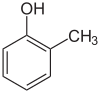 |
 |

|
| o-Kresol | m-Kresol | p-Kresol |
Die Kürzel o- (kurz für ortho, von griech. orthós für aufrecht, gerade)[9], m- (meta, griech. etwa für zwischen)[10] und p- (para, von griech. pará für neben, zur Seite)[11] beschreiben die drei möglichen Stellungsisomere zweier Substituenten an einem Benzol-Ring. In der Regel handelt es sich hierbei um zwei unabhängige Einzelsubstituenten, bei kondensierten Ringsystemen wird jedoch auch von ortho-Anellierung gesprochen oder das Substitutionsmuster geht wie beispielsweise beim [2.2]Paracyclophan in die Namensgebung des Moleküls ein. In der aktuellen systematischen Nomenklatur sind o-, m- und p- vielfach durch die Angabe von Lokanten abgelöst (1,2-Dimethylbenzol statt o-Xylol).
o-, m- und p- oder auch ausgeschrieben ortho-, meta- und para- werden stets klein und kursiv geschrieben.
exo-, endo-
[Bearbeiten | Quelltext bearbeiten]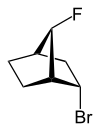 |
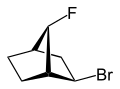
|
| 2-endo-Brom-7-syn-fluor- bicyclo[2.2.1]heptan |
2-exo-Brom-7-syn-fluor- bicyclo[2.2.1]heptan |
 |

|
| 2-endo-Brom-7-anti-fluor- bicyclo[2.2.1]heptan |
2-exo-Brom-7-anti-fluor- bicyclo[2.2.1]heptan |
Mit exo- (von griechisch = außen)[12] oder endo- (von griechisch endon = innen)[13] wird die relative Konfiguration von verbrückten bicyclischen Verbindungen gekennzeichnet. Entscheidend für die Zuordnung von exo- oder endo- ist die Stellung eines Substituenten im Hauptring relativ zur kürzesten Brücke (nach IUPAC: Die Brücke mit den höchsten Lokantenziffern[14]) im verbrückten Ringsystem. Ist der zu klassifizierende Substituent dieser Brücke zugewandt, wird ihm der Deskriptor exo- zugeschrieben, richtet er sich von der Brücke weg, ist er endo-konfiguriert.
Befinden sich am gleichen C-Atom zwei unterschiedliche Substituenten, entscheidet sich die exo-/endo-Zuordnung nach der höheren Priorität gemäß den CIP-Regeln.
syn-, anti-
[Bearbeiten | Quelltext bearbeiten]Trägt ein verbrücktes bicyclisches System an der kürzesten Brücke einen Substituenten, ist diesem keine Zuordnung eines exo- oder endo-Deskriptors möglich. Diese Isomere werden anhand der syn-/anti-Notation klassifiziert.[14] Zeigt der zu bestimmende Substituent zu dem Ring mit der höchsten Anzahl an Ringgliedern (oder bei Gleichheit zu dem Ring mit dem höchstwertigen Substituenten nach den CIP-Regeln), so ist er syn-konfiguriert (von griech. syn... = zusammen[15]), andernfalls wird ihm der Deskriptor anti (griech. gegen)[16] zugeschrieben.

Veraltet ist dagegen die Verwendung von syn- und anti- für die Angabe der Konfiguration von Doppelbindungen, insbesondere bei Aldoximen und von Aldehyden abgeleiteten Hydrazonen. Hier wurden die Verbindungen als syn-konfiguriert bezeichnet, wenn das Aldehyd-H und das -O (des Oxims) bzw. das -N (des Hydrazons) cis-ständig waren. Diese Verbindungen werden heute mit der (E)-, (Z)-Nomenklatur beschrieben. Früher als syn-klassifizierte Aldoxime und Hydrazone sind daher heute als (E)-konfiguriert zu beschreiben.[15]
syn- und anti- werden immer klein und kursiv geschrieben, Lokanten werden gegebenenfalls vorangestellt und mit Bindestrichen abgetrennt.
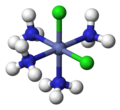
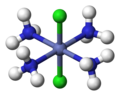
fac-, mer-
[Bearbeiten | Quelltext bearbeiten]Mit den Bezeichnungen fac- (von lateinisch facies = Angesicht)[17] und mer- (von meridonal-)[18] kann bei oktaedrischen Komplexen mit drei gleichartigen Liganden deren Anordnung um das Zentralatom spezifiziert werden. Heute gilt diese Nomenklatur als veraltet, ist aber noch zulässig.[19][20] Die Vorsilbe fac- beschreibt dabei die Situation, wenn die drei gleichartigen Liganden die drei Ecken einer Oktaeder-Dreieckfläche einnehmen, in mer-konfigurierten Komplexen spannen die drei Liganden dagegen eine Ebene auf, in der auch das Zentralatom zu liegen kommt.
-
fac-[CoCl3(NH3)3]
-
mer-[CoCl3(NH3)3]
fac- und mer- werden klein und kursiv dem Komplexnamen vorangestellt.
n-, iso-, neo-, cyclo-
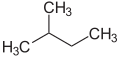
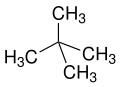
[Bearbeiten | Quelltext bearbeiten]Die Vorsilben n- (normal-), iso- (von griechisch ísos = gleich)[21], neo- (griech. néos = jung, neu)[22] und cyclo- (griech. kyklos = Kreis)[23] dienen in erster Linie dazu, die Anordnung von Atomen, meist von Kohlenstoffatomen in Kohlenstoffgerüsten näher zu beschreiben. n-, iso- und neo- werden in der systematischen Nomenklatur nicht mehr verwendet, sind aber in Trivialnamen und im Laborjargon noch häufig in Gebrauch.
Das Präfix n- beschreibt ein geradkettiges Kohlenstoffgerüst ohne Verzweigungen, iso- im Gegensatz dazu ein verzweigtes Gerüst, ohne dies näher zu spezifizieren. Allgemeiner steht iso- für eine Verbindung, die isomer zur n-Verbindung ist, bei der also einzelne Atome oder Atomgruppen in der Anordnung verändert sind.
neo- ist eine als Vorsilbe unspezifische Bezeichnung für „neuen“, also meist synthetisch hergestellten Stoffe oder Isomere von lange bekannten n-Verbindungen oder Naturstoffen (beispielsweise Neomenthol abgeleitet von Menthol oder Neoabietinsäure von Abietinsäure). Nach IUPAC ist neo- nur für Neopentan bzw. den Neopentylrest empfohlen.[24][25]
cyclo- ist eine häufig genutzte Vorsilbe für alle cyclischen und heterocyclischen Verbindungen. In vielen Eigennamen von chemischen Substanzen ist cyclo- nicht als Vorsilbe vorangestellt, sondern direkt in den Namen integriert, beispielsweise bei Cyclohexan oder Cyclooctatetraen.
-
n-Pentan
-
iso-Pentan
-
neo-Pentan
-
Cyclopentan
n-, iso-, neo- werden klein und kursiv geschrieben, cyclo- dagegen üblicherweise nur in anorganischen Verbindungen.[26] In organischen Verbindungen gilt „Cyclo“ häufig als Namensbestandteil, wird nicht mit einem Bindestrich abgetrennt und auch bei alphabetischen Sortierungen berücksichtigt. Bei den Substituentengruppen Neopentyl, sowie Isopropyl, Isobutyl, Isopentyl und Isohexyl werden die Trivialbezeichnungen nach der IUPAC-Nomenklatur beibehalten und „Neo“, bzw. „Iso“ ebenfalls nicht mit Bindestrich abgetrennt.[27]
sec-, tert-
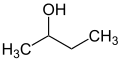
[Bearbeiten | Quelltext bearbeiten]Die Vorsilben sec- und tert- dienen der Kenntlichmachung von Substituentenumgebung in einem Molekül. Es wird also nicht die exakte Position des Substituenten bezeichnet, sondern lediglich das Substitutionsmuster des benachbarten Atoms (meist eines Kohlenstoffatoms) beschrieben. So befindet sich im n-Butanol die OH-Gruppe an einem primären Kohlenstoffatom, im sec-Butanol an einem sekundären und im tert-Butanol ist das verknüpfende Kohlenstoffatom tertiär.
-
n-Butanol
-
sec-Butanol
-
tert-Butanol
Die Bezeichnungen sec- und tert- gelten als veraltet und sind nur noch für unsubstituiertes sec-Butoxy- und sec-Butyl- empfohlen[28][25][29] bzw. für tert-Butyl- zu verwenden.[30][25] Es existiert eine Vielzahl von Schreibweisen wie „sek.-Butyl-“, „s-Butyl-“, „sBu-“, „Bus-“, die ebenfalls als veraltet gelten.[31][32]
spiro
[Bearbeiten | Quelltext bearbeiten]
Das Präfix „spiro“ gefolgt von einem Von-Baeyer-Deskriptor beschreibt in der Nomenklatur organischer Verbindungen die Verknüpfung von Ringsystemen mit nur einem gemeinsamen Atom, dem Spiroatom. Sind mehrere Spiroatome im Molekül enthalten, wird die Vorsilbe „spiro“ mit einem der Anzahl der Spiroatome entsprechenden Vorsatz versehen („dispiro“, „trispiro“ etc.). Typographisch wird „spiro“ normal gesetzt.[33]
catena-
[Bearbeiten | Quelltext bearbeiten]Die Bezeichnung catena- wird in der anorganischen Nomenklatur[34] genutzt, um lineare, kettenförmige Polymere aus identischen mehratomigen Einheiten[35] zu beschreiben. Ein Beispiel hierfür sind die Catenatriphosphazene.[36][37] Verwandte Verbindungen in der organischen Chemie sind die Catenane.
Stereochemische Deskriptoren zur Beschreibung absoluter Konfigurationen
[Bearbeiten | Quelltext bearbeiten](R)-, (S)-
[Bearbeiten | Quelltext bearbeiten]
Die stereochemischen Deskriptoren (R)- (von lat. rectus = rechts) und (S)- (von lat. sinister = links)[38] dienen der eindeutigen Beschreibung der absoluten Konfiguration eines Stereozentrums, meist eines chiralen Kohlenstoffatoms.[39] Hierzu werden alle Substituenten am Stereozentrum gemäß den CIP-Regeln priorisiert und der Substituent mit der niedrigsten Priorität („D“) von der Blickrichtung weggerichtet. Beschreiben die verbleibenden Substituenten in absteigender Prioritätenfolge („A“→„B“→„C“) einen Kreis mit Drehsinn nach links, so ist das Stereozentrum (S)-konfiguriert, ist der Drehsinn rechtsgerichtet, wird dem Stereozentrum die (R)-Konfiguration zugewiesen.
Enthält ein Molekül mehrere Stereozentren, muss dem Deskriptor ein Lokant vorangestellt werden (beispielsweise in (1R,2S)-2-Amino-1-phenyl-propan-1-ol, der systematischen Bezeichnung von Norephedrin). Sind alle Stereozentren gleich konfiguriert, kann zugunsten einer „(all-R)-“ oder „(all-S)-“Schreibweise auf die Nennung der Lokanten verzichtet werden.
Typographisch werden (R)- und (S)- in Großbuchstaben und kursiv; die häufig vorangestellten Lokanten, die umschließenden runden Klammern und Kommata werden in Normalschrift gesetzt.
(r)-, (s)-
[Bearbeiten | Quelltext bearbeiten]Die Deskriptoren (r)- und (s)- werden verwendet, um die absolute Konfiguration pseudoasymmetrischer (pseudochiraler) Zentren zu beschreiben.[40] Pseudoasymmetrie liegt dann vor, wenn an einem Kohlenstoffatom vier unterschiedliche Substituenten gebunden sind, von denen sich zwei aber lediglich durch ihre absolute stereochemische Konfiguration unterscheiden. Beispiele hierfür sind die Tropanalkaloide und deren Stammverbindung Tropin, systematisch (1R,3r,5S)-8-Methyl-8-azabicyclo[3.2.1]octan-3-ol: Das Kohlenstoffatom C-3, an dem die –OH-Gruppe gebunden ist, ist pseudoasymmetrisch; der stereochemische Deskriptor im systematischen Namen wird klein und kursiv geschrieben.
D-, L-
[Bearbeiten | Quelltext bearbeiten]-
Konstruktion der Fischer-Projektion
-
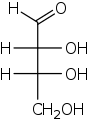
D-Glucose in der Fischer-Projektion.
Rot: Gruppe mit höchster Priorität,
blau: Zur Bestimmung von D-/L- maßgebliche Gruppe,
violett: Gruppe mit achiralem C-Atom
Die Stereodeskriptoren D- (von lateinisch dexter ‚rechts‘) und L- (lateinisch laevus ‚links‘) werden zur Beschreibung der Konfiguration von α-Aminosäuren und Zuckern verwendet.[41] Das räumlich aufgebaute Molekül muss zunächst in einer fest definierten Schreibweise als zweidimensionale Abbildung („Fischer-Projektion“) notiert werden.[42] Hierbei wird das C-Atom mit der nach den normalen Nomenklaturregeln höchsten Priorität oben angeordnet und die weitere Kohlenstoffkette senkrecht darunter. Für die Zuweisung von D- oder L- ist dasjenige chirale C-Atom entscheidend, das am weitesten von der Gruppe mit der höchsten Priorität entfernt ist. Kommt der Rest an diesem C-Atom (meist eine OH-Gruppe) links der Kohlenstoffkette zu liegen, stammt das Molekül aus der L-Reihe, liegt der Rest rechts, wird es mit dem Deskriptor D- beschrieben.[43]
Die Deskriptoren D- und L- werden als Kapitälchen geschrieben und mit einem Bindestrich vom übrigen Namen getrennt.[44]
meso-
[Bearbeiten | Quelltext bearbeiten]
Mit dem Deskriptor meso- werden Verbindungen gekennzeichnet, die zwei (oder eine höhere geradzahlige Anzahl) stereogene Zentren besitzen und in mindestens einer Konformation vorliegen können, die eine cs-Symmetrie, d. h. eine Drehspiegelachse oder Spiegelebene oder Punktsymmetrie, hat.[45] Moleküle, die dieser Definition entsprechen, sind achiral und optisch inaktiv. Ein Beispiel hierfür ist die meso-Weinsäure.[46][47]
meso- wird klein und kursiv geschrieben vor den Substanznamen gesetzt.
(P)-, (M)-
[Bearbeiten | Quelltext bearbeiten]-
(P)-Heptahelicen
-
(M)-Heptahelicen
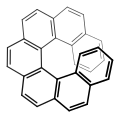
Die Enantiomere axial-chiraler Verbindungen werden mit den stereochemischen Deskriptoren „Plus“ (P)- und „Minus“ (M)- gekennzeichnet.[48] Auch die Notation (R) und (S), in komplizierteren Fällen auch Ra und Sa, wobei der Index „a“ für „axial“ steht, ist gebräuchlich.
Auch helicale (schraubenförmige) Moleküle (beispielsweise die Helicene) werden mit den Deskriptoren (P)- und (M)- beschrieben, wobei Molekülen mit rechtsgängiger Helix der Deskriptor (P)- zugeordnet wird, linksgängigen der Deskriptor (M)-.[49]
Die Deskriptoren (P)- und (M)- werden, ebenso wie (R)- und (S)-, kursiv und in runden Klammern vor den Substanznamen gesetzt.
Stereochemische Deskriptoren zur Beschreibung unbekannter Konfigurationen
[Bearbeiten | Quelltext bearbeiten](RS)-
[Bearbeiten | Quelltext bearbeiten]Ist die absolute Konfiguration eines Stereozentrums nicht bekannt, wird sie mit (RS)- beschrieben, ein zweites Stereozentrum im gleichen Molekül kann dann zur Kenntlichmachung der entgegengesetzten absoluten Konfiguration mit (SR)- bezeichnet werden.[50]
(R*)-, (S*)-
[Bearbeiten | Quelltext bearbeiten]Ist dagegen die absolute Konfiguration eines Stereozentrums bekannt, eines oder aller anderen Stereozentren dagegen unbekannt, so dient die bekannte Konfiguration als Referenz, die weiteren Stereozentren werden entsprechend ihrer relativer Konfiguration zum Referenzzentrum mit (R*)- bzw. (S*)- gekennzeichnet.[51][52]
Relative Konfiguration von Racematen
[Bearbeiten | Quelltext bearbeiten]Bisweilen werden die Deskriptoren (R*) und (S*) auch zur Kennzeichnung der relativen Konfiguration von Racematen verwendet, z. B. so: (1R*, 2R*)-(±) ist ein 1:1-Gemisch (Racemat) aus dem Enantiomer mit (1R, 2R)-Konfiguration und dem Enantiomer mit (1S, 2S)-Konfiguration. Hingegen ist (1S*, 2R*)-(±) ein 1:1-Gemisch (Racemat) aus dem Enantiomer mit (1S, 2R)-Konfiguration und dem Enantiomer mit (1R, 2S)-Konfiguration. Diese Nomenklatur ist verbreitet, entspricht jedoch nicht den IUPAC-Regeln.[53]
(ξ)-, (Ξ)-, ξ-, Ξ-
[Bearbeiten | Quelltext bearbeiten]Auch der griechische Buchstabe Xi kann genutzt werden, um ein Stereozentrum unbekannter Konfiguration zu kennzeichnen.[54] Dabei wird die Typographie an diejenige des Deskriptors angepasst, der im Falle einer bestimmten stereochemischen Konfiguration zu verwenden wäre: Ein klammerloses kleines ξ- steht für „c/t-“, „cis/trans-“, „endo/exo-“ oder „anti/syn-“; (r/s)- dagegen wird durch (ξ)- mit Klammern ersetzt.[55] Großgeschrieben steht Ξ- für „D-“ oder „L-“ und mit Klammern (Ξ)- für „(R)-“ oder „(S)-“ bzw. „(E)-“ oder „(Z)-“.[56]
rel-
[Bearbeiten | Quelltext bearbeiten]Sind in einem Molekül die absoluten Konfigurationen der Stereozentren nicht bekannt, ist deren relative Konfiguration zueinander jedoch ermittelt, so erfolgt eine Kennzeichnung mit dem Präfix rel-.[57][58] Beispielsweise ist (rel-2R,3S,4R)-Hexan-2,3,4-triol so zu verstehen, dass das Molekül entweder in der (2R,3S,4R)-Konfiguration vorliegt oder als (2S,3R,4S)-Isomer.
Der Deskriptor rel- wird klein und kursiv geschrieben direkt vor den ersten Lokanten des systematischen Substanznamens gesetzt.
Stereochemische Deskriptoren zur Beschreibung von Enantiomerengemischen
[Bearbeiten | Quelltext bearbeiten]In systematischen Namen ist das Fehlen eindeutiger stereochemischer Deskriptoren als Hinweis auf das Vorliegen eines Racemats zu interpretieren.[59]
rac-
[Bearbeiten | Quelltext bearbeiten]Die dem Namen vorangestellte Bezeichnung rac- dient zur Verdeutlichung der Tatsache, dass ein äquimolares Gemisch[60] von Enantiomeren vorliegt, das keine optische Aktivität zeigt. Synonym dazu ist das (±)-Symbol zu betrachten.
ambo-
[Bearbeiten | Quelltext bearbeiten]Die Bezeichnung ambo- (von lat. ambo = beide) findet an Stelle von (RS)- oder rac-Verwendung, wenn die beiden Isomere nicht exakt im Verhältnis 1:1 vorliegen, sondern dieses Mischungsverhältnis nur in Etwa einnehmen[61] oder das exakte Mischungsverhältnis unbekannt ist.[62] Der Deskriptor ambo- wird kleingeschrieben und kursiv vor den Namen des betroffenen Moleküls bzw. der Teilstruktur gesetzt (Beispiel: L-Alanyl-ambo-leucin).
Stereochemische Deskriptoren zur Beschreibung relativer Konfigurationen
[Bearbeiten | Quelltext bearbeiten]α-, β-
[Bearbeiten | Quelltext bearbeiten]Kohlenhydrate
[Bearbeiten | Quelltext bearbeiten] |
|
| α-D-Glucopyranose | β-D-Glucopyranose |
 |
|
| α-D-Ribopyranose | β-D-Ribopyranose |
| Beispiele für α-/β-Anomere: Lokanten (rot), Anomeres Zentrum (blauer Pfeil), Referenzatom (grüner Pfeil), CIP-Konfiguration (grau) | |
Die Deskriptoren α- und β- werden im Bereich der Kohlenhydratchemie genutzt, um die Konfiguration des sogenannten anomeren C-Atoms relativ zu einem Referenzatom zu beschreiben. Als anomeres C-Atom (auch „anomeres Zentrum“ genannt) wird das C-Atom der Aldosen oder Ketosen bezeichnet, das beim Übergang von der offenkettigen zur Ringform (zur halbacetalischen bzw. halbketalischen Pyranose-Form oder Furanose-Form) vom prochiralen zu einem neuen Stereozentrum wird.[63] Das anomere Zentrum hat nach den Nomenklaturregeln im Ring die höchste Priorität und trägt daher die Lokantenziffer 1. Das Referenzatom ist das chirale Atom mit der höchsten Lokantenziffer innerhalb des Moleküls. Liegen anomeres Zentrum und Referenzatom in der gleichen Konfiguration (R/R)- bzw. (S/S)- vor, so handelt es sich um das β-Anomer, bei (R/S)-Konfiguration liegt das α-Anomer vor.[64][65]
Der anomere Deskriptor α oder β wird, durch einen Bindestrich abgetrennt, direkt vor den Konfigurationsdeskriptor D- bzw. L- und den Namen des Moleküls gesetzt.
Steroide
[Bearbeiten | Quelltext bearbeiten]
(13β-Methyl-gonan).
Im Rahmen der Steroid-Nomenklatur finden die Deskriptoren α- und β- ebenfalls Verwendung.[64][66] Hier werden üblicherweise Substituenten, die sich im Halbraum oberhalb der Ringebene befinden, als β-ständig bezeichnet, diejenigen unterhalb der Ringebene als α-ständig. So befindet sich beispielsweise die 13-Methylgruppe im Estran β-ständig.
Beziehen sich die Deskriptoren α- und β- auf Steroide oder strukturell ähnliche Naturstoffe mit verknüpften Ringen, so schließen sie sich direkt an die jeweiligen Lokanten an und werden kursiv gesetzt.
threo-, erythro-
[Bearbeiten | Quelltext bearbeiten]-
D-Threose
-
D-Erythrose
Die stereochemischen Bezeichnungen threo- und erythro- leiten sich von der Konfiguration der Verbindungen Threose und Erythrose ab[67][68] und lassen sich übertragen auf Verbindungen mit genau zwei benachbarten Stereozentren. Sind die Reste (meist OH-Gruppen) an diesen Stereozentren in der Fischer-Projektion auf der gleichen Seite angeordnet, liegt eine erythro-Verbindung vor, bei wechselseitiger Anordnung der Reste ist es eine threo-Verbindung.
Von der IUPAC wird die Verwendung von threo- und erythro- nicht mehr empfohlen, stattdessen ist die bei komplizierteren Fällen präzisere (R)-/(S)- oder die (l)-/(u)-Nomenklatur vorzuziehen.[69]
ribo-, arabino-, xylo-, lyxo-
[Bearbeiten | Quelltext bearbeiten]Die stereochemischen Bezeichnungen ribo-, arabino-, xylo- und lyxo- leiten sich von der Konfiguration der Aldopentosen Ribose, Arabinose, Xylose und Lyxose ab. Diese können auch als ribo-Pentose, arabino-Pentose, xylo-Pentose bzw. lyxo-Pentose bezeichnet werden.[70]
(l)-, (u)-
[Bearbeiten | Quelltext bearbeiten]Zur Klassifikation einer Verbindung mit zwei Stereozentren als (l)- (von engl. like) oder (u)- (engl. unlike) wird betrachtet, ob die Konfiguration der beiden Stereozentren nach den CIP-Regeln identisch, also (R,R) bzw. (S,S) ist – in diesem Falle liegt eine like (l)-Verbindung vor, bei (R,S) bzw. (S,R) eine unlike (u)-Verbindung.[71]
(l)- bzw. (u)- werden mit kleinen Kursivbuchstaben in runden Klammern mit Bindestrich dem Substanznamen vorangestellt.
ent-, epi-
[Bearbeiten | Quelltext bearbeiten]Die Vorsilbe ent- (kurz für enantio-) vor dem Namen einer chemischen Verbindung, meist eines Naturstoffs, dient zur Kennzeichnung, dass die beschriebene Verbindung eine Stereochemie aufweist, die zur Stereochemie der Referenzverbindung spiegelbildlich („enantiomer“) aufgebaut ist.[72][73]
-
Testosteron
-
17-epi-Testosteron
Der Deskriptor epi- wurde dagegen verwendet, um zu kennzeichnen, dass genau ein Stereozentrum spiegelbildlich zur natürlich vorkommenden Verbindung konfiguriert ist.[74]
allo-
[Bearbeiten | Quelltext bearbeiten]
Das Präfix allo- (von griech. allos = ein anderer)[75] wird für mehrere unterschiedliche Sachverhalte verwendet. Im Bereich der Kohlenhydrate kennzeichnet es eine relative Konfiguration von vier stereogenen Zentren, die derjenigen der Allose entspricht, bei der in der Fischer-Projektion alle OH-Gruppen auf der gleichen Seite der Kohlenstoffkette liegen.
Im Bereich der Nomenklatur von Aminosäuren mit zwei chiralen Zentren wurde in der Vergangenheit der Name demjenigen Aminosäure-Diastereomer zugewiesen, das zuerst entdeckt wurde. Der Trivialname des nachfolgend gefundenen oder synthetisierten Diastereomers wurde dann mit dem Präfix allo- versehen. Diese Methode wurde nur bei Trivialnamen, nicht bei halbsystematischen oder systematischen Namen angewandt und wird heute nur noch für allo-Isoleucin und allo-Threonin empfohlen.[76]
Als Präfix wird allo- immer klein und kursiv vor den Namen gestellt, es existieren jedoch chemische Verbindungen, bei denen „Allo-“ ein Namensbestandteil ist (beispielsweise Allozimtsäure oder Alloocimen), hier ist es zu vermeiden, dass „Allo“ klein und kursiv vorangestellt wird.[75]
Deskriptoren zur Beschreibung physikalischer Eigenschaften
[Bearbeiten | Quelltext bearbeiten](+)-, (−)-, (±)-
[Bearbeiten | Quelltext bearbeiten]Eine physikalische Eigenschaft nicht-racemischer Mischungen chiraler Verbindungen ist ihre Fähigkeit, die Ebene polarisierten Lichtes um einen bestimmten Winkel zu drehen. Dieser Drehwinkel ist abhängig von der Konzentration der Lösung, vom Lösungsmittel und von der Länge des Messweges.
Zur Benennung chiraler Verbindungen kann daher (neben dem systematischen Namen und der absoluten stereochemischen Konfiguration) auch der Drehsinn der optischen Rotation angegeben werden. Hierfür wird dem Substanznamen eines der Zeichen (+)- bzw. (−)- vorangestellt.[77]
Racemische Gemische von Verbindungen mit nur einem Stereozentrum werden mit vorangestelltem (±)- beschrieben.[50]
Aus der (+)-/(−)-Angabe können keine direkten Rückschlüsse auf die absolute Konfiguration eines Moleküls gezogen werden, die Deskriptoren (+)- und (−)- sind weder mit (R)- und (S)-, noch mit D- und L- äquivalent. Aus dem Deskriptor (±)- folgt jedoch, dass ein Stoffgemisch (Racemat = 1:1-Gemisch aus zwei Enantiomeren) vorliegt, d. h. (±)- ist äquivalent mit den Deskriptoren (RS)- und DL-.
Subtraktionspräfixe
[Bearbeiten | Quelltext bearbeiten]Subtraktionspräfixe wie zum Beispiel Des-, Nor- und Anhydro- geben an, dass aus einer Stammverbindung etwas abgespalten wurde oder etwas „fehlt“.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu stereodescriptor. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.S05976 – Version: 2.3.1.
- ↑ Eintrag zu cis-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu trans-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ IUPAC-Regeln E-2, E-3 (PDF; 542 kB).
- ↑ IUPAC-Regel R-7.1.1.
- ↑ a b G. P. Moss: Basic terminology of stereochemistry (IUPAC Recommendations 1996). In: Pure and Applied Chemistry. Band 68, Nr. 12, 1. Januar 1996, S. 2193–2222, doi:10.1351/pac199668122193.
- ↑ Eintrag zu s-cis-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Oktober 2019.
- ↑ Eintrag zu E, Z. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.E01882 – Version: 2.3.2.
- ↑ Eintrag zu Ortho-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu Met(a).... In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu Para-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu exo-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu endo-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ a b Eintrag zu endo, exo, syn, anti. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.E02094 – Version: 2.3.2.
- ↑ a b Eintrag zu syn-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu Anti-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu fac-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu Mer. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu fac-. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.F02313 – Version: 2.3.2.
- ↑ Eintrag zu mer-. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.M03828 – Version: 2.3.2.
- ↑ Eintrag zu Iso.... In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu Neo.... In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu Cyclo.... In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ IUPAC-Regeln A-2.1, A-2.25.
- ↑ a b c IUPAC-Regel R-9.1, Tabelle 19b.
- ↑ Eintrag zu cyclo-. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C01495 – Version: 2.3.2.
- ↑ Dieter Hellwinkel: Die systematische Nomenklatur der Organischen Chemie: Eine Gebrauchsanweisung. 5. Auflage. Springer-Verlag, Berlin/Heidelberg 2006, ISBN 978-3-540-26411-8, S. 11.
- ↑ IUPAC-Regeln A-2.25, C-205.1, R-5.5.1.1.
- ↑ IUPAC-Regel R-9.1, Tabelle 26b.
- ↑ IUPAC-Regel A-2.25.
- ↑ Eintrag zu sec-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu tert-Butyl.... In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ IUPAC: Nomenklatur von Spiro-Verbindungen, abgerufen am 23. Mai 2016.
- ↑ Eintrag zu catena-. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C00903 – Version: 2.3.2.
- ↑ Eintrag zu catena-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ S. Gorter and G. C. Verschoor: The crystal structure of catena-tri-µ2-(1,12-dodecanedinitrile)copper(II)hexachloroantimonate(V) Cu(C12H20N2)3(SbCl6)2. In: Acta Cryst. (1976). B32, 1704–1707, doi:10.1107/S0567740876006262.
- ↑ IUPAC-Regeln D-4.4, I-9.7.3 und I-10.8.3.5.
- ↑ Eintrag zu CIP-Regeln. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu R,S. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.R05423 – Version: 2.3.2.
- ↑ Eintrag zu pseudo-asymmetric carbon atom. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.P04921.
- ↑ Eintrag zu d, l, dl. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.D01512 – Version: 2.3.2.
- ↑ Eintrag zu Fischer–Rosanoff convention (or Rosanoff convention). In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.F02392 – Version: 2.3.2.
- ↑ Eintrag zu d. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ K.-H. Hellwich: Stereochemie. Springer, 2007, ISBN 3-540-71708-0. S. 11 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Bernhard Testa: Grundlagen der Organischen Stereochemie, Verlag Chemie, Weinheim, 1983, S. 54–56, ISBN 3-527-25935-X.
- ↑ Eintrag zu meso-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu meso. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.M03838 – Version: 2.3.2.
- ↑ Eintrag zu axial chirality. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00547 – Version: 2.3.2.
- ↑ Eintrag zu helicity. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.H02763 – Version: 2.3.2.
- ↑ a b Eintrag zu RS. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu relative configuration. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.R05260 – Version: 2.3.2.
- ↑ Eintrag zu Konfiguration. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Bernhard Testa: Grundlagen der Organischen Stereochemie, Verlag Chemie, Weinheim, 1983, S. 57–58, ISBN 3-527-25935-X.
- ↑ IUPAC: Nomenclature and Symbolism for Amino Acids and Peptides (Recommendations 1983) (PDF; 539 kB), S. 601.
- ↑ Eintrag zu ξ. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu Ξ. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu rel-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu relative configuration. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.R05254 – Version: 2.3.3.
- ↑ Eintrag zu rac-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu racemate. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.R05025 – Version: 2.3.2.
- ↑ Eintrag zu ambo-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu ambo. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00261 – Version: 2.3.2.
- ↑ Eintrag zu Anomere. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ a b Eintrag zu α (alpha), β (beta). In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00003 – Version: 2.3.2.
- ↑ IUPAC: Nomenclature of Carbohydrates 2-Carb-6 and 2-Carb-7 (Recommendations 1996).
- ↑ G. P. Moss: Nomenclature of steroids (Recommendations 1989). In: Pure and Applied Chemistry. Band 61, Heft 10, S. 1783–1822, doi:10.1351/pac198961101783.
- ↑ Eintrag zu threo-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu Erythr(o).... In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu erythro, threo. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.E02212 – Version: 2.3.2.
- ↑ Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Royal Society of Chemistry, Cambridge 2014, ISBN 978-0-85404-182-4, P-10, P-102 Carbohydrate Nomenclature (qmul.ac.uk).
- ↑ Eintrag zu l,u. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.L03423 – Version: 2.3.2.
- ↑ Eintrag zu ent-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ IUPAC-Regeln F-6.4, RF-10.3
- ↑ Eintrag zu epi-. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. Mai 2013.
- ↑ a b Eintrag zu Allo…. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.
- ↑ Eintrag zu allo- in amino-acid nomenclature. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00239 – Version: 2.3.2.
- ↑ Eintrag zu optische Aktivität. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. September 2012.

![fac-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/69/Fac-trichlorotriamminecobalt%28III%29.png/109px-Fac-trichlorotriamminecobalt%28III%29.png)
![mer-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/54/Mer-trichlorotriamminecobalt%28III%29.png/120px-Mer-trichlorotriamminecobalt%28III%29.png)