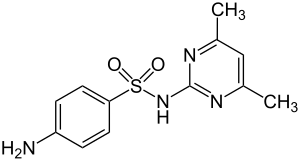
Sulfadimidin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Sulfadimidin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C12H14N4O2S | |||||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 278,3 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Sulfadimidin (auch Sulfamethazin) ist ein Antibiotikum aus der Gruppe der Sulfonamide, der als Natriumsalz in der Veterinärmedizin zur Behandlung bakterieller und parasitärer Infektionskrankheiten (zum Beispiel Kokzidiose[3] oder Diphtheroide Erkrankungen[4]) verwendet wird. Der mittellang wirkende Arzneistoff wird im Gegensatz zu anderen Sulfonamiden therapeutisch als Einzelsubstanz verwendet.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Sulfadimidin wurde 1942 von Ward Blenkinsop, 1943 von I.C.I., 1946 von Sharp & Dohme und 1964 von Ist. Chemioterap. Ital. patentiert.[2] Der Patentschutz ist inzwischen ausgelaufen.[5] Von der Firma Cilag wurde die Substanz als Diazil auf den Markt gebracht[6] (vgl. auch Bracco (Unternehmen)).
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Sulfadimidin kann durch Reaktion von 4-Acetylaminobenzolsulfonylchlorid mit 2-Amino-4,6-dimethylpyrimidin gewonnen werden und anschließender Hydrolyse der Acetylaminogruppe synthetisiert wird. Das 2-Amino-4,6-dimethylpyrimidin wird dafür wiederum durch Kondensation von Acetylaceton mit Guanidin dargestellt.[7][8] Es kann auch direkt durch Reaktion von Sulfanilylguanidin mit Acetylaceton dargestellt werden.[9]
Klinik und Pharmakologie
[Bearbeiten | Quelltext bearbeiten]Sulfadimidin hemmt kompetitiv ein Enzym des Stoffwechselweges der Folsäure-Synthese, welches die Dihydropteroinsäure-Bildung katalysiert. Die Toxizität des Antibiotikums ist gering. Eine Ausnahme stellen manche Hühner dar, bei denen toxische Effekte schon im therapeutischen Dosisbereich auftreten können. Nach Anwendung senkt Sulfadimidin die Legeleistung.[10]
Trivia
[Bearbeiten | Quelltext bearbeiten]Sulfadimidin ist für bestimmte bodenbewohnende Bakterien kein Gift, sondern vielmehr eine willkommene Futterquelle. Die Verbindung, die in der Tierhaltung eingesetzt wird, gelangt über die Gülle auf Felder und in den Boden[11]. Die Bakterien, die zur Gattung Microbacterium gehören, nutzen den Stickstoff und den Kohlenstoff aus der chemischen Verbindung gezielt für ihren Stoffwechsel.[12][13]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt Sulfamethazin bei Sigma-Aldrich, abgerufen am 3. Juni 2017 (PDF).
- ↑ a b c d e f g h Eintrag zu Sulfadimidin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Juli 2014.
- ↑ Michael Fehr, Lutz Sassenburg, Peernel Zwart: Krankheiten der Heimtiere. Schlütersche, 2014, ISBN 978-3-8426-8593-2, S. 235 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Gerrit Dirksen: Innere Medizin und Chirurgie des Rindes. Georg Thieme Verlag, 2006, ISBN 978-3-8304-4169-4, S. 290 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Joint FAO/WHO Expert Committee on Food Additives: Residues of Some Veterinary Drugs in Animals and Foods Monographs Prepared by the Thirty-Fourth Meeting of the Joint FAO/WHO Expert Committee on Food Additives, Geneva, 30 January-8 February 1989. Food & Agriculture Org., 1990, ISBN 978-92-5102933-6, S. 101 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Karl Wurm, A. M. Walter: Infektionskrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 9–223, hier: S. 43–45.
- ↑ Ruben Vardanyan, Victor Hruby: Synthesis of Essential Drugs. Elsevier, 2006, ISBN 978-0-08-046212-7, S. 503 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Profiles of Drug Substances, Excipients and Related Methodology. Academic Press, 1978, ISBN 978-0-08-086102-9, S. 413 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, International Agency for Research on Cancer, World Health Organization: Some Thyrotropic Agents. World Health Organization, 2001, ISBN 978-92-832-1279-9, S. 341 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H. Frey, W. Löscher u. a.: Lehrbuch der Pharmakologie und Toxikologie für die Veterinärmedizin. 3. Auflage. Enke, 2009, ISBN 978-3-8304-1079-9, S. 452ff.
- ↑ Reinhard Röder: Tierarzneimittel in der Umwelt. Oldenbourg Industrieverlag, 2007, ISBN 978-3-8356-3135-9, S. 98 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ bild der wissenschaft: Antibiotikum wird zum Bakterienfutter - bild der wissenschaft, abgerufen am 1. Juli 2017.
- ↑ Edward Topp, Ralph Chapman, Marion Devers-Lamrani, Alain Hartmann, Romain Marti, Fabrice Martin-Laurent, Lyne Sabourin, Andrew Scott, Mark Sumarah: Accelerated Biodegradation of Veterinary Antibiotics in Agricultural Soil following Long-Term Exposure, and Isolation of a Sulfamethazine-degrading sp.. In: Journal of Environment Quality. 42, 2013, S. 173, doi:10.2134/jeq2012.0162.