Trichlorsilan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
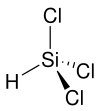
| ||||||||||||||||
| Keile zur Verdeutlichung der Geometrie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Trichlorsilan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | SiHCl3 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 135,45 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
1,34 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
32 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
heftige Zersetzung in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Trichlorsilan (auch Trichlormonosilan oder Siliciumchloroform genannt) ist eine Verbindung aus der Gruppe der Halogensilane.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Industriell wird Trichlorsilan durch Reaktion von Chlorwasserstoff mit Silicium bei hohen Temperaturen hergestellt. Dieses Verfahren wurde bereits 1857 bei der ersten Synthese von Friedrich Wöhler und Heinrich Buff beschrieben.[3]
Auch bei der Reaktion von Tetrachlorsilan mit Silicium und Wasserstoff bei erhöhter Temperatur wird Trichlorsilan gebildet.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Trichlorsilan ist eine bei Standardbedingungen flüssige Verbindung. Die farblose, rauchende, hochentzündliche Flüssigkeit verströmt einen stechenden Geruch. Die Dämpfe sind schwerer als Luft und breiten sich daher am Boden aus, was eine Fernzündung ermöglicht. Bereits durch bloßen Kontakt mit Luft ist Selbstentzündung möglich. Bei Erhitzung zersetzt sich die Verbindung und es entstehen giftige oder ätzende Gase wie beispielsweise Chlorwasserstoff (HCl). In Gegenwart verschiedener Katalysatoren erfolgt Disproportionierung in Tetrachlorsilan und Monosilan:[4]
Trichlorsilan reagiert heftig mit Oxidationsmitteln, Aminen, Ammoniak, Aceton und starken Säuren. Metalle werden von Trichlorsilan angegriffen, wobei brennbare Gase (wie beispielsweise Wasserstoff) gebildet werden.
Zur Beförderung wird Trichlorsilan der Klasse 4.3 zugeordnet und hat die Gefahrenkennzeichnung X338 (leicht entzündlich, ätzend, mit Wasser gefährlich reagierend).
Verwendung
[Bearbeiten | Quelltext bearbeiten]Trichlorsilan ist Zwischenprodukt bei der Herstellung von Solarsilicium. Das zu reinigende Silicium reagiert mit Chlorwasserstoff zu Trichlorsilan und Wasserstoff, wobei als Nebenprodukte auch Siliciumtetrachlorid SiCl4, Hexachlordisilan Si2Cl6 und Dichlorsilan SiH2Cl2 entstehen:
Danach wird das Trichlorsilan in einem aufwändigen Verfahren destilliert und an beheizten Reinstsiliciumstäben zu Silicium, Siliciumtetrachlorid und Chlorwasserstoff zersetzt:
Abgeleitete Verbindungen
[Bearbeiten | Quelltext bearbeiten]- Octadecyltrichlorsilan (OTS)
- Perfluoroctyltrichlorsilan (PFOTCS)
- Perfluordecyltrichlorsilan (FDTS)
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Eintrag zu Trichlorsilan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Eintrag zu Trichlorsilan im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 26. Juli 2023. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ H. Buff, F. Wöhler: Ueber neue Verbindungen des Siliciums. In: Annalen der Chemie und Pharmacie. Band 104, Nr. 1, 1857, S. 94–109, doi:10.1002/jlac.18571040108.
- ↑ a b Barry Arkles: Silanes. (pdf) Reprint from Kirk-Othmer Encyclopedia of Chemical Technology, Forth Edition, Volume 22, S. 38–69. In: Gelest. S. 39, abgerufen am 10. Dezember 2016 (englisch).







