Bariumchromat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
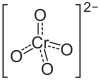
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bariumchromat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | BaCrO4 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 253,32 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte |
4,5 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt |
210 °C[2] | ||||||||||||||||||
| Löslichkeit |
sehr schwer in Wasser (0,34 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
0,5 mg·m−3 Barium[3] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Bariumchromat ist ein Bariumsalz der Chromsäure. Es besitzt die Formel BaCrO4 und gehört zu Stoffgruppe der Chromate.
Gewinnung/Darstellung
[Bearbeiten | Quelltext bearbeiten]Das gelbe Bariumchromat wird durch Fällung von Bariumionen mit Chromationen aus leicht saurer Lösung gewonnen.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bariumchromat ist ein gelber Feststoff, der praktisch wasserunlöslich und deswegen im Gegensatz zu den meisten anderen Chromaten nicht akut giftig ist, so dass die Sicherheitshinweise für lösliche Chromate für Bariumchromat nur eingeschränkt gelten. Andererseits sind gerade schwerlösliche Chromatpartikel im Falle inhalatorischer Exposition besonders stark karzinogen und Bariumchromat zeigt eine Klastogenwirkung, die über die klassischen genotoxischen Wirkungen löslicher Chrom(VI)-Verbindungen hinausgeht.[4] Wie alle Chromate wirkt auch Bariumchromat oxidierend, besonders stark unter sauren Bedingungen. Es zeigt die für Barium typische grüne Flammenfärbung.
Beim Erhitzen mit Bariumcarbonat wird das sechswertige Chrom zum fünfwertigen reduziert, es bildet sich Bariumchromat(V) Ba3(CrO4)2.[5]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Bariumchromat wird in der Glas- und Farbenindustrie als Pigment eingesetzt. In der Pyrotechnik wird Bariumchromat als Oxidationsmittel und zur Grünfärbung verwendet.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu Bariumchromat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. Juni 2014.
- ↑ a b c d e f Eintrag zu Bariumchromat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Datenblatt Bariumchromat bei Alfa Aesar, abgerufen am 14. März 2010 (Seite nicht mehr abrufbar).
- ↑ S. S. Wise, A. L. Holmes, Q. Qin, H. Xie, S. P. Katsifis, W. D. Thompson, J. P. Wise: Comparative genotoxicity and cytotoxicity of four hexavalent chromium compounds in human bronchial cells. In: Chemical research in toxicology. Band 23, Nummer 2, Februar 2010, S. 365–372, doi:10.1021/tx900363j, PMID 20000473, PMC 2822000 (freier Volltext).
- ↑ K. A. Wilhelmi, O. Jonsson: X-Ray Studies on Some Alkali and Alkaline-Earth Chromates(V). In: Acta Chemica Scandinavica 1965, 19, S. 177–184, doi:10.3891/acta.chem.scand.19-0177.




