10-Undecen-1-ol
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | 10-Undecen-1-ol | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C11H22O | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 170,29 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, löslich in Alkoholen wie Ethanol[4], in Diethylether[4], in Chlorkohlenwasserstoffen wie Dichlormethan[5] und Tetrahydrofuran[6], sowie in Pyridin | |||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
10-Undecen-1-ol ist ein natürlich vorkommendes, lineares Alkenol mit endständiger Ethenylgruppe, das durch Reduzierung von Undecylensäure oder von 10-Undecensäuremethylester – der wiederum einfach durch Spaltung von Ricinusöl zugänglich ist – erhalten wird.
Natürliches Vorkommen
[Bearbeiten | Quelltext bearbeiten]
10-Undecen-1-ol kommt im Öl von Litsea odorifera Valeton, einem in Indonesien heimischen Lorbeergewächs, vor.[7]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Reduktion von 10-Undecensäure mit Lithiumaluminiumhydrid in Diethylether ergibt 10-Undecenol in praktisch quantitativer Ausbeute.[8]
Aus Ethylundecenoat wird 10-Undecenol durch Bouveault-Blanc-Reduktion mit metallischem Natrium und Ethanol in Ausbeuten bis 82 % d.Th. erhalten.[9]

Der Methylester der 10-Undecensäure kann auch schonend mit Titantetraisopropoxid (TIPT) und Polymethylhydrosiloxan (PMHS) in 78%iger Ausbeute zum 10-Undecenol reduziert werden.[10]
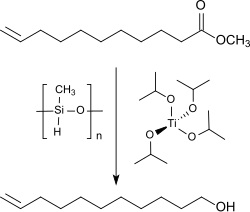
Eine weitere verwandte Alternative stellt die Reaktion des Methylesters mit Titantetraisopropoxid (TIPT) und Triethoxysilan für 16 Stunden bei 50 °C und anschließende Hydrolyse mit Natriumhydroxid dar. Die Ausbeute liegt bei 87 % d.Th.[11]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]10-Undecen-1-ol ist reinem Zustand eine klare, farblose Flüssigkeit, die bei Temperaturen unterhalb −3 °C zu einer wachsartigen Masse erstarrt. Sein Geruch wird als seifig, wachsartig, blumiges Rosenaroma beschrieben.[12]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Durch Reaktion von 10-Undecen-1-ol mit tosyliertem β-Cyclodextrin entsteht ein β-Cyclodextrin-undecenylether, der kovalent auf einer angeätzten Glasoberfläche als Monolayer fixiert werden kann, wobei die C11-Kohlenwasserstoffkette als hydrophober Abstandshalter (engl. spacer) fungiert.[6]

Cholesterol aus Milch bildet Einschlussverbindungen mit dem immobilisierten β-Cyclodextrin durch Einlagerung in den hydrophoben Hohlraum. Innerhalb von 4 Stunden werden bei 25 °C 73,6 % des Cholesterols aus der Milch extrahiert; der höchste bis dahin erzielte Wert für einen solchen Testaufbau.
Durch radikalische Addition von bifunktionellen Thiolen an 10-Undecen-1-ol entstehen telechele monodisperse Mercaptoalkohole, die als Vorstufen für Polyester, Polyurethane und Polyamide eingesetzt werden können.[13]
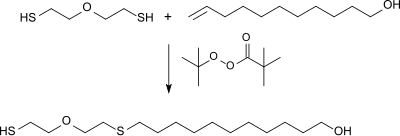
Mit dem Peroxyester t-Butylperoxypivalat als Radikalstarter und durch tropfenweise Zugabe des 10-Undecenols in einen großen Überschuss von 2-Mercaptoethylether (2,2′-Oxydiethanthiol) kann eine quantitative Ausbeute des telechelen Mercaptoalkohols erzielt werden.
10-Undecen-1-ol reagiert mit Kohlenmonoxid in Gegenwart von Alkoxycarbonylierungskatalysatoren, wie z. B. Dicobaltoctacarbonyl Co2(CO)8 und einer Stickstoffbase, wie z. B. Pyridin bei Drücken >150 bar und Temperaturen im Bereich von 100 bis 200 °C zu linearen und verzweigten Polyestern mit relativ hohen Molmassen (Mn >10,000 g/mol) in guten Ausbeuten.[14]

Die erhaltenen Polyester sind bioabbaubar und eigen sich zur Herstellung von Folien, Fasern und Formkörpern.
In einer Thiol-En-Reaktion (Click-Chemie)[15] von 10-Undecen-1-ol mit Mercaptoalkoholen, wie Mercaptoethanol oder 3-Mercaptopropanol können α,ω-Diole hergestellt werden, die sich zur Synthese thermoplastischer Polyester[16] oder Polyurethane eignen.

Bei der durch Licht, ggf. unter Zuhilfenahme von Photoinitiatoren, wie z. B. Dimethoxyphenylacetophenon (DMPA), ausgelösten radikalischen Addition der Thiolgruppe an die endständige Doppelbindung entstehen praktisch quantitativ Thioether.
10-Undecenylacrylat wird durch Umsetzung von 10-Undecen-1-ol mit Acryloylchlorid und Triethylamin in einer Ausbeute von 78 % d.Th. erhalten.[5]

In Gegenwart von Grubbs-Katalysatoren reagiert Undecenylacrylat (C14-Molekül) als quasi-α,ω-Dien in einer Acyclischen Dienmetathese ADMET-Reaktion unter Kopf-Schwanz-Verknüpfung und Abspaltung äquimolarer Mengen von Ethen zum entsprechenden Poly-Dien mit C12-Wiederholungseinheit.
Die Homopolymerisation des 10-Undecen-1-ols als langkettigem und sterisch anspruchsvollem Olefin mit polarer Endgruppe macht erhebliche Schwierigkeiten. Es gelingt mit Metallocen-Katalysatoren, insbesondere mit rac-Ethylen-bis[Indenyl]zirkondichlorid, und dem Cokatalysator (Aktivator) Methylaluminoxan, das durch Umsetzung mit Triisobutylaluminium zum 10-Undecenyloxy-diisobutylaluminium geschützte Monomer unter optimalen Bedingungen mit bescheidenen Ausbeuten von 50 bis 60 % und niedrigen Molmassen M4<104 g/mol zu überwiegend isotaktischen Makromonomeren umzusetzen.[17]

Die Copolymerisation von geschütztem 10-Undecen-1-ol mit 10-Undecen erzeugt statistische Copolymere mit geringen Molmassen (Mn<104 g/mol), während die Copolymerisation von allylterminiertem Poly(10-Undecen-1-ol) mit Propen keine eindeutig identifizierbaren Produkte (entweder Copolymer mit wenig eingebautem Polyundecenol oder Polymerblend aus Polypropylen und Polyundecenol) liefert.
10-Undecen-1-ol kann in Polypropylen zur Erzeugung hydrophilerer Polymeroberflächen und damit verbesserter Klebeeigenschaften eingebaut werden durch Copolymerisation mit Propen mittels Zirkon-Metallocenkatalysatoren,[18]

allerdings wegen der geringen Polymerisationsneigung des langkettigen Olefinalkohols nur mit 0,1–0,9 mol% bzw. 0.5.–3,6 Gew.%.
Der Einbau von 10-Undecen-1-ol in Copolymere mit Ethen mit höheren Molmassen und Gehalten an Hydroxygruppen gelingt mit phenoxybasierten Zirkonkomplexen.[19]
Neuere Komplexe des Vanadin(III)-chlorids ermöglichen die Herstellung von Copolymeren von Ethen und mit Triethylaluminium umgesetzten, geschütztem 10-Undecen-1-ol unter milden Bedingungen, die bis zu 15,8 mol% des langkettigen Alkohols enthalten.
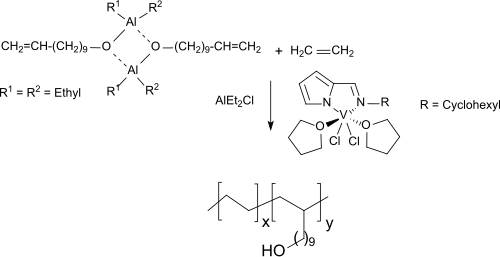
Die neuen Vanadinkomplexe werden als wirksamere Copolymerisationskatalysatoren beschrieben als die bisher verwendeten Zirkonmetallocene.
Wegen seiner einfachen Zugänglichkeit aus dem in reichlich und preisgünstig verfügbaren Pflanzenöl Ricinusöl, das als nachwachsender Rohstoff nicht in Konkurrenz zur Nahrungsmittelerzeugung steht, hat 10-Undecen-1-ol ein gewisses Potential als zukünftiger biogener Synthesebaustein.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu UNDECYLENYL ALCOHOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. Januar 2022.
- ↑ a b c d e f Datenblatt 10-Undecen-1-ol 99 % bei Alfa Aesar, abgerufen am 22. November 2014 (Seite nicht mehr abrufbar).
- ↑ a b c d e f g Datenblatt 10-Undecen-1-ol 98 % bei Sigma-Aldrich, abgerufen am 22. November 2014 (PDF).
- ↑ a b W.M. Haynes: Handbook of Chemistry and Physics, 95th ed., 2014–2015. CRC Press, Boca Raton, 2014, ISBN 978-1-4822-0867-2, S. 3–544.
- ↑ a b L. Montero de Espinosa, M.A.R. Meier: Synthesis of star- and block-copolymers using ADMET: head-to-tail selectivity during step-growth polymerization. In: Chem. Commun. Band 47, 2012, S. 1908–1910, doi:10.1039/C0CC04161K.
- ↑ a b M.N. Tahir, C. Kwon, D. Jeong, E. Cho, S.R. Paik, S. Jung: Cholesterol reduction from milk using β-cyclodextrin immobilized on glass. In: J. Dairy Sci. Band 96, 2013, S. 4191–4196, doi:10.3168/jds.2012-6355.
- ↑ P. van Romburgh: The essential oil Litsea odorifera Val. (Trawas oil) Prel. Comm. In: KNAW Proceedings. 14 I, 1911 (knaw.nl [PDF; 150 kB]).
- ↑ Patent US3941884: Piperonyl ethers having juvenile hormone mimetic activity. Angemeldet am 10. Januar 1974, veröffentlicht am 2. März 1976, Anmelder: Chevron Research Co., Erfinder: L.H. Edwards.
- ↑ D.G.M. Diaper: Preparation of undecenol and undecenyl bromide. In: Canadian Journal of Chemistry. 39 (8), 1961, S. 1723–1727, doi:10.1139/v61-220.
- ↑ M. T. Reding, S. L. Buchwald: An inexpensive air-stable titanium-based system for the conversion of esters to primary alcohols. In: J. Org. Chem. Band 60, Nr. 24, 1995, S. 7884–7890, doi:10.1021/jo00129a031.
- ↑ G.L. Larson, J.L. Fry: Ionic and organometallic-catalyzed organosilane reductions. Wiley, 2010, ISBN 978-0-470-54787-8, S. 132.
- ↑ Product Information ( vom 5. Dezember 2014 im Internet Archive)
- ↑ B. Ameduri, K. Berrada, B. Boutevin, R.D. Bowden: Synthesis of a telechelic monodispersed mercapto-alcohol. In: Polymer Bull. Band 31, Nr. 1, 1993, S. 1–7, doi:10.1007/BF00298756.
- ↑ Patent EP2258743A2: Herstellung von Polyestern aus nachwachsenden Rohstoffen. Angemeldet am 2. Juni 2010, veröffentlicht am 8. Dezember 2010, Anmelder: BASF SE, Erfinder: T.H. Steinke, H.-H. Görtz, S. Mecking, D. Quinzler.
- ↑ C.E. Hoyle, C.N. Bowman: Thiol-En-Klickchemie. In: Angew. Chem. Band 122, Nr. 9, 2010, S. 1584–1617, doi:10.1002/ange.200903924.
- ↑ C. Pang, J. Zhang, G. Wu, Y. Wang, H. Gao, J. Ma: Renewable polyesters derived from 10-undecenoic acid and vanillic acid with versatile properties. In: Polym. Chem. Band 5, 2014, S. 2843–2853, doi:10.1039/C3PY01546G.
- ↑ M. Johannsen: Metallocen-katalysierte Synthese von polaren Olefinbasierten Makromonomeren. Dissertation Technische Universität Dresden. 2011 (qucosa.de ( vom 5. Dezember 2014 im Internet Archive) [PDF; 3,6 MB]).
- ↑ S. Paavola, R. Uotila, B. Löfgren, J.V. Seppälä: Enhanced adhesive properties of polypropylene through copolymerization with 10-undecen-1-ol. In: React Funct Polym. Band 61, Nr. 1, 2004, S. 53–62, doi:10.1016/j.reactfunctpolym.2004.03.009.
- ↑ X. Zhang, S. Chen, H. Li, Z. Zhang, Y. Lu, C. Wu, Y. Hu: Highly active copolymerization of ethylene with 10-undecen-1-ol using phenoxy-based zirconium/methylaluminoxane catalysts. In: J. Polym. Sci. A Polym. Chem. Band 43, Nr. 23, 2005, S. 5944–5952, doi:10.1006/pola.21105.
