10-Undecenal
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||||||||
| Name | 10-Undecenal | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C11H20O | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 168,28 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser und Glycerin, löslich in 1,2-Propandiol[3] | ||||||||||||||||||
| Brechungsindex |
1,441–1,447 (20 °C, 589 nm)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
10-Undecenal ist ein ungesättigter mittelkettiger C11–Aldehyd mit endständiger Doppelbindung. Wegen seiner als „aldehydische Note“ beschriebenen olfaktorischen Eigenschaften wird Undecylenaldehyd als Geschmacks- und Geruchsstoff in Lebensmitteln und Konsumartikeln eingesetzt.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]
In der Natur kommt 10-Undecenal in den Blättern des Echten Korianders (Coriandrum sativum L.) vor.[4]
Die chemische Synthese von Undecylenaldehyd geht aus von Undecylensäure (10-Undecensäure), die durch Pyrolyse von Ricinolsäure aus Ricinusöl in großen Mengen zur Verfügung steht. 10-Undecensäure wird mit Thionylchlorid in das Säurechlorid überführt und 10-Undecenoylchlorid in einer Rosenmund-Reduktion an einem mit Thioharnstoff teilvergifteten Palladium-Katalysator auf Bariumsulfat BaSO4 zum Aldehyd hydriert.[6]
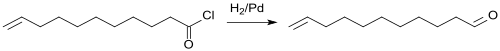
Die Ausbeute der Rosenmund-Reduktion ist für Undecensäurechlorid mit 55 % allerdings bescheiden. Bei optimierter Prozessführung können jedoch bessere Ausbeuten und Produktqualitäten erzielt werden.[7]
Mit gesättigten langkettigen (C10 – C16) Carbonsäurechloriden werden mit der Rosenmund-Reduktion Ausbeuten > 90 % erreicht.[8]
Eine (allerdings teure) Alternative stellt die Reduktion des Undecenoylchlorids mit Indiumtrihydrid InH3 (aus Tributylzinnhydrid und Indium(III)-chlorid) dar, das zur Stabilisierung mit Tricyclohexylphosphan komplexiert ist (Ausbeute 91 %).[9]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]10-Undecylenaldehyd ist eine farblose bis blassgelbe, blumig riechende Flüssigkeit.[10] Sie schmeckt unangenehm süß und fettig und riecht in Verdünnung nach Rosen.[11] In Verdünnung unter 1 ppm schmeckt sie fruchtig und nach Zitronen.[12] Die Substanz fällt in die Duftkategorie der aldehydischen Düfte und wird als wachsartig, frisch, nach Citrus und Rosen riechend charakterisiert.[13] 10-Undecenal löst sich in Alkoholen und Diolen, wie z. B. Propylenglycol, einem gängigen Lösungsmittel für Aromen und Duftstoffe.[14]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]10-Undecenal als Synthesebaustein
[Bearbeiten | Quelltext bearbeiten]Bei der Aldolkondensation von Undecenylaldehyd mit Cyanessigsäure entsteht in Gegenwart der Base N,N-Dimethylbenzylamin (DMBA) das cis-trans-Isomerengemisch des 3,12-Tridecadiennitrils, dessen Geruch als frisch, citrisch-mandarinig, natürlich, leicht fruchtig und sehr duftstark beschrieben wird.[15]

Neben seiner „wesentlich natürlicheren Note“ als andere Nitrile soll das Kondensationsprodukt cis-trans-3,12-Tridecadiennitril Riechstoffkompositionen „eine größere Duftfülle und insbesondere eine größere Natürlichkeit“ verleihen.
Als relativ einfach zugängliches Derivat des nachwachsenden Rohstoffs Ricinusöl wird 10-Undecenal u. a. auf seine Eignung als Baustein für Polykondensate untersucht.[16] Durch Selbst-Metathese in Gegenwart eines Grubbs-Hoveyda I-Katalysators entsteht Eicos-10-en-1,20-dial, das zu dem α,ω-C20-Diol Eicosan-1,20-diol hydriert werden kann. Mit einem Grubbs-Hoveyda-Katalysator II (2. Generation) und Acrolein bildet sich Dodec-10-en-1,12-dial und bei dessen Hydrierung das α,ω-C12-Diol Dodecan-1,12-diol.

Diese α,ω-bifunktionellen Diole können als Diolkomponente in Polyestern und Polyurethanen eingesetzt werden.[17]
10-Undecenal als Riechstoff
[Bearbeiten | Quelltext bearbeiten]Aufgrund seiner vielschichtigen Riechstoffeigenschaften wird 10-Undecenal in Kombination mit anderen Geruchsstoffen und ätherischen Ölen als substantielle Geruchskomponente in Parfüms verwendet („In perfumery, 10-undecenal is one of the aldehydes essential for creating the “aldehydic note”[18]). 10-Undecenal wird außerdem zur Parfümierung von Kosmetika, Haar- und Körperpflegeprodukten, Wasch- und Reinigungsmitteln usw. eingesetzt.
In der Parfümerie wird es für Rosen-, Orangen-, Jasmin-, Muskateller- und Veilchenduftnoten verwendet.[10]
Isomerisierung von 10-Undecylenaldehyd erzeugt durch Verschiebung der endständigen Doppelbindung ein Gemisch von Undecenaldehyden, wie z. B. 8-, 9- und 10-Undecenal und die entsprechenden (Z)-(E)-Isomere, mit deutlich unterschiedlichen Duftnuancen.[19]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Horst Surburg, Johannes Panten: Common Fragrance and Flavor Materials: Preparation, Properties and Uses, 6th ed. Wiley-VCH, Weinheim, 2016, ISBN 978-3-527-33160-4
- George A. Burdock, Hrsg.: Fenaroli’s Handbook of Flavor Ingredients, 6th ed. CRC Press, Boca Raton, FL, USA, 2010, ISBN 978-1-4200-9077-2
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Undecylenic aldehyde bei Sigma-Aldrich, abgerufen am 1. Dezember 2020 (PDF).
- ↑ a b c d e Eintrag zu Undecenylaldehyde bei Thermo Fisher Scientific, abgerufen am 1. Dezember 2020.
- ↑ a b Eintrag zu 10-Undecenal bei TCI Europe, abgerufen am 1. Dezember 2020.
- ↑ a b George A. Burdock (Hrsg.): Fenaroli’s Handbook of Flavor Ingredients, 6th Edition. CRC Press, Boca Raton, FL, USA 2010, ISBN 978-1-4200-9077-2, S. 1981.
- ↑ Eintrag zu 10-Undecenal in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ J. English, Jr., S.F. Velick: The Rosenmund reduction of undecylenoyl chloride. In: J. Amer. Chem. Soc. Band 67, Nr. 8, 1945, S. 1413–1414, doi:10.1021/ja01224a051.
- ↑ V.G. Yadav, S.B. Chandalia: Synthesis of aldehydes by Rosenmund reduction. In: Org. Process Res. Dev. Band 1, Nr. 3, 1997, S. 226–232, doi:10.1021/op960024j.
- ↑ H.B. White, Jr., L.L. Sulya, C.E. Cain: Application of the Rosenmund reaction to the synthesis of saturated fatty aldehydes. In: J. Lipid Res. Band 8, 1967, S. 158–160 (jlr.org [PDF]).
- ↑ K. Inoue, M. Yasuda, I. Shibata, A. Baba: Selective reduction of acid chloride with a catalytic amount of an indium compound. In: Tetrahedron Lett. Band 41, Nr. 1, 2000, S. 113–116, doi:10.1016/S0040-4039(99)02016-X.
- ↑ a b Eintrag zu Undec-10-enal. In: Römpp Online. Georg Thieme Verlag, abgerufen am 18. November 2021.
- ↑ George A. Burdock: Encyclopedia of Food and Color Additives. CRC Press, 1997, ISBN 0-8493-9414-7, S. 2873 (books.google.com).
- ↑ Steffen Arctander: Perfume & Flavor Chemicals (Aroma Chemicals) Vol.III. Lulu.com, 2019, ISBN 978-0-244-18394-3 (books.google.com).
- ↑ Aldehyde C-11 Undecylenic. PerfumersWorld Ltd., abgerufen am 1. Dezember 2020.
- ↑ 10-undecenal (aldehyde C-11 undecylenic). TGSC Information System, abgerufen am 1. Dezember 2020.
- ↑ Patent EP0419980A1: Alkadiennitrile, Verfahren zu ihrer Herstellung und ihre Verwendung. Angemeldet am 15. September 1990, veröffentlicht am 3. April 1991, Anmelder: Haarmann & Reimer GmbH, Erfinder: R. Hopp, T. Thielmann, W. Götsch.
- ↑ L. Montero de Espinosa, M.A.R. Meier: Plant oils: The perfect resource for polymer science?! In: Eur. Polym. J. Band 47, Nr. 5, 2010, S. 837–851, doi:10.1016/j.eurpolymj.2010.11.020.
- ↑ X. Miao, C. Fischmeister, C. Bruneau, P. Dixneuf: A direct route to bifunctional aldehyde derivatives via self- and cross-metathesis of unsaturated aldehydes. In: ChemSusChem. Band 2, Nr. 6, 2009, S. 542–545, doi:10.1002/cssc.200900028.
- ↑ B. Elvers (Hrsg.): Ullmann’s Food and Feed, Volume 1. Wiley-VCH, Weinheim 2017, ISBN 978-3-527-33990-7, S. 1062.
- ↑ Intreleven Aldehyde. IFF International Flavors and Fragrances, abgerufen am 8. Dezember 2020.

