Vanadium(IV)-oxid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ V4+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Vanadium(IV)-oxid | |||||||||||||||
| Andere Namen |
Vanadiumdioxid | |||||||||||||||
| Verhältnisformel | VO2 | |||||||||||||||
| Kurzbeschreibung |
dunkelgrünschwarzer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 82,94 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
4,34 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Vanadium(IV)-oxid ist eines von mehreren Oxiden des Vanadiums. Es ist ein hochschmelzender, schwarzer Feststoff. Vanadium(IV)-oxid spielt eine wichtige Rolle bei der katalytischen Umsetzung von Schwefeldioxid zu Schwefeltrioxid im Kontaktverfahren zur Schwefelsäureherstellung.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Vanadium(IV)-oxid lässt sich aus Vanadium(V)-oxid gewinnen. Dieses wandelt sich beim Erhitzen mit schwachen Reduktionsmitteln, wie Kohlenstoffmonoxid, Schwefeldioxid oder Oxalsäure in Vanadium(IV)-oxid um:
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
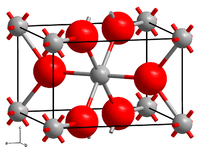
[Bearbeiten | Quelltext bearbeiten]Vanadium(IV)-oxid besitzt zwei verschiedene Modifikationen, die sich bei 70 °C ineinander umwandeln. Unterhalb von 70 °C besitzt es eine verzerrte Rutil-Struktur, in der jeweils zwei Vanadiumatome durch eine Bindung miteinander verbunden sind. Oberhalb von 70 °C brechen diese Bindungen auf. Dabei bildet sich eine unverzerrte Rutilstruktur aus. Gleichzeitig erhöht sich die elektrische Leitfähigkeit und der Paramagnetismus deutlich.
Neuere Untersuchungen an einkristallinen Nanodrähten von Vanadium(IV)-oxid ergaben, dass bei 65,0 °C ein Tripelpunkt von einer metallischen und zwei isolierende Phasen des Metalloxids vorliegt. Nur geringste Änderungen dieser Bedingungen reichten aus, um jeweils nur eine einzige Phase zu stabilisieren, wobei sich die Wechsel binnen weniger Pikosekunden vollziehen.[4] In der metallischen Hochtemperatur (Rutil, R)-Phase sind alle Ketten gerade und regelmäßig, während in der nicht leitenden Niedertemperaturphase (monoklin M1) jede Kette dimerisiert. Es gibt auch zwei andere bekannte isolierende Phasen: eine monokline M2, in denen nur ein Satz von Ketten dimerisiert und eine trikline, die ein Zwischenprodukt von M1 und M2 darstellt. Das Vorhandensein von sowohl M1 und M2, mit ähnlichen dielektrischen Eigenschaften aber unterschiedlichen magnetischen Eigenschaften liefert Einschränkungen der bisherigen Theorie von Metall-Isolator-Übergängen. Zum Beispiel schließt es einen reinen Peierls-Mechanismus aus.[5]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Vanadium(IV)-oxid ist wie Titan(IV)-oxid amphoter, es löst sich sowohl in starken Säuren, als auch in starken Basen. Mit Säuren bildet es [VO(H2O)5]2+-Ionen, mit Basen [VO(OH)3]−-Ionen.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Während der Schwefelsäureproduktion im Kontaktverfahren entsteht durch Übertragung eines Sauerstoffions vom Vanadium(V)-oxid auf das Schwefeldioxid Vanadium(IV)-oxid. Die Rückgewinnung des eingesetzten Vanadium(V)-oxids erfolgt durch Oxidation mit Sauerstoff.
Bedingt durch die Umwandlung zwischen den unterschiedlichen Phasen lässt sich Vanadium(IV)-oxid als optischer Schalter verwenden. Es wandelt sich bei 68 °C in kürzester Zeit von einem Infrarot transparenten und halbleitenden in einen spiegelnden und leitenden Zustand um.[6] Durch Einbringen geringer Mengen Wolfram in Vanadiumdioxid lässt sich die Umwandlungstemperatur auf etwa 29 °C senken, was das Oxid zur hitzeabweisenden Beschichtung von Glasflächen geeignet macht.[7][8] Es zeigt einen Memory-Effekt der für neuartige Datenspeicher genutzt werden könnte.[9]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag zu Vanadium(IV)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. Juli 2008. (JavaScript erforderlich)
- ↑ a b Datenblatt Vanadium(IV) oxide bei Sigma-Aldrich, abgerufen am 25. April 2011 (PDF).
- ↑ Georg Brauer: Niedere Vanadinoxyde: . In: Handbuch der Präparativen Anorganischen Chemie. Ferdinand Enke Verlag, Stuttgart 1954, S. 951.
- ↑ Wissenschaft-aktuell: Komplizierte Phasenwechsel: Wo drei Zustände aufeinander treffen
- ↑ Jae Hyung Park, Jim M. Coy, T. Serkan Kasirga, Chunming Huang, Zaiyao Fei, Scott Hunter, David H. Cobden: Measurement of a solid-state triple point at the metal–insulator transition in VO2. In: Nature. 500, 2013, S. 431–434, doi:10.1038/nature12425.
- ↑ Leonard C. Feldman: Timing nature’s fastest optical shutter, physorg.com, 7. April 2005.
- ↑ Spektrumdirekt: Glasbeschichtung lässt Hitze draußen. Meldung vom 9. August 2004.
- ↑ Troy D. Manning and Ivan P. Parkin: "Atmospheric pressure chemical vapour deposition of tungsten doped vanadium(IV) oxide from VOCl3, water and WCl6", Journal of Materials Chemistry 2004, 14, 2554–2559; doi:10.1039/b403576n.
- ↑ Mohammad Samizadeh Nikoo, Reza Soleimanzadeh, Anna Krammer, Guilherme Migliato Marega, Yunkyu Park: Electrical control of glass-like dynamics in vanadium dioxide for data storage and processing. In: Nature Electronics. 22. August 2022, S. 1–8, doi:10.1038/s41928-022-00812-z (nature.com [abgerufen am 26. August 2022]).
Literatur
[Bearbeiten | Quelltext bearbeiten]- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1548.





