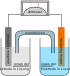
Voltasche Säule


Die Volta’sche Säule oder auch Voltasäule ist die erste elektrische Batterie, die eine praktische Bedeutung als Stromquelle erlangte. Sie wurde von Alessandro Volta um 1799 entwickelt und der Royal Society im Jahr 1800 in London vorgestellt.[1][2] Sie besteht aus vielen übereinander geschichteten Kupfer- und Zinkplättchen, zwischen denen sich in bestimmter regelmäßiger Folge elektrolytgetränkte Papp- oder Lederstücke befinden. Anstelle von Kupfer wurden auch Silber und statt Zink auch Zinn verwendet. Die chemischen Abläufe in den Zellen wurden erst später genauer verstanden.
Ein einzelnes Element der Volta’schen Säule wird Voltaelement genannt. Es besteht beispielsweise aus einer Kupferfolie, einer Elektrolytschicht und einer Zinkfolie. Es liefert nur eine geringe Spannung, weshalb in der Säule mehrere solcher Elemente übereinander gestapelt werden. Dabei ergibt sich die Stapelfolge Kupfer, Elektrolyt, Zink, Kupfer, Elektrolyt und wieder Zink, d. h., Kupfer und Zink wechseln sich ab und der Elektrolyt befindet sich in diesem Beispiel immer zwischen Kupfer (unten) und Zink (oben).
Bedeutung
[Bearbeiten | Quelltext bearbeiten]Die Volta’sche Säule war einfach aufgebaut und sie sowie die darauf aufbauenden Daniell- und Grove-Elemente dienten der gesamten elektrischen Industrie als Stromquellen, bis zur Erfindung des elektrischen Generators in den 1870er Jahren.
Mit ihrer Hilfe wurden in schneller Folge weitere Entdeckungen auf dem Gebiet der Elektrizität gemacht, so die Elektrolyse von Wasser durch William Nicholson und Anthony Carlisle (1800) und die erstmalige Darstellung vieler unedler Elemente, insbesondere der Metalle Natrium und Kalium im Jahr 1807, sowie Barium, Strontium, Calcium, Magnesium und Bor im Jahr 1808 durch Humphry Davy.[3][4] Sie fand auch Anwendung in der Entwicklung der Galvanik sowie bei den ersten Versuchen zur Nachrichtenübermittlung durch die elektrische Telegrafie.
Anwendung in der Technik
[Bearbeiten | Quelltext bearbeiten]
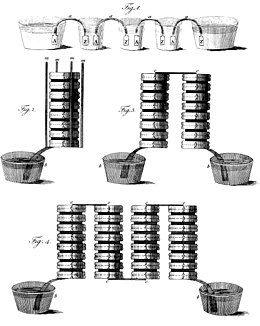
Die zusätzlichen Kupfer- bzw. (hier dargestellten) Silber- (A) und Zink-Platten (Z) die bei Voltas Original-Zellen jeweils den unteren und oberen Abschluss des Stapels bilden,[1] hatten keine technische Funktion.
Mit Hilfe der Volta’schen Säule bzw. Nachfolgern und damit erzeugten Lichtbögen wurde eine elektrische Beleuchtung mit Bogenlampen realisiert. Bogenlampen sind die ältesten elektrischen Lichtquellen. Johann Samuel Halle (1792) und der Brite Humphry Davy (1802) haben den Effekt des Lichtbogens beobachtet und zur Beleuchtung angewendet. Es wurden Messing- bzw. Graphitelektroden eingesetzt, wobei die Graphitelektroden relativ schnell abbrannten.
Eine der ersten Anwendungen in der Schiffstechnik erfolgten durch Moritz Hermann von Jacobi, der 1839 in Sankt Petersburg mit Hilfe einer liegenden Volta’schen Säule und einem von ihm entwickelten und gebauten Elektromotor das erste Elektroboot antrieb. Die Versuche wurden auf St. Petersburger Kanälen und der Newa durchgeführt und von einer staatlichen Kommission abgenommen.
Anwendung in der Medizin
[Bearbeiten | Quelltext bearbeiten]Schon ab 1801 wurde über eine Vielzahl von Versuchen berichtet, die Voltasche Säule medizinisch zu nutzen.[5] Beispielsweise wurde vorgeschlagen, sie zur Unterscheidung von Toten und Scheintoten zu nutzen.[6] Trotz einiger angeblichen Erfolge blieb die therapeutische Anwendung, die Galvanotherapie, damals wegen der noch weitgehend unverstandenen Wirkungen beschränkt.[5] Die Galvanotherapie wurde später von Golding Bird und von Robert Remak weiterentwickelt.
Funktionsweise
[Bearbeiten | Quelltext bearbeiten]Bei der Volta’schen Säule handelt es sich um eine Folge von in Reihe geschalteten galvanischen Zellen. Am negativen Pol, der hier die Anode darstellt, da hier die Oxidation stattfindet, geht das unedlere Metall in Lösung: Das Zinkplättchen löst sich auf: Jedes Zinkatom, das als Zinkion in Lösung geht, gibt zwei Elektronen ab; in der Zinkelektrode entsteht so ein Elektronenüberschuss, weshalb sie den negativen Pol bildet.
Als Elektrolyt verwendete man Salzwasser, Lauge (beides testete Volta[7]) oder Säure beziehungsweise damit getränktes Papier, Textil (Volta nennt ein Tuch[7]) oder Leder.
An der positiven Elektrode, der Kathode, da hier die Reduktion stattfindet, sind mehrere Reaktionen möglich. Volta verwendete zunächst Silber oder auch versilbertes Kupfer.[7] Handelt es sich um Kupferplatten, die nicht poliert werden, sind sie mit einer Oxidschicht bedeckt. Dann läuft zunächst die Reduktion ab. Diese kann auch erfolgen, wenn das Kupfer aufgrund der Anwesenheit von Luftsauerstoff in Lösung gegangen ist.
Die Volta’sche Säule funktioniert aber auch, wenn poliertes Kupfer oder Silber als Elektroden verwendet werden, wenn also gar keine Kupfer- oder Silberionen vorhanden sind. Dann wird Sauerstoff aus der Luft am Kupfer oder Silber reduziert: Verwendet man an Stelle eines neutralen Elektrolyten (z. B. Salzwasser) einen sauren (z. B. Essig oder verdünnte Schwefelsäure oder Salzsäure), so werden am Kupfer bzw. Silber Wasserstoffionen reduziert. Die Wasserstoffentwicklung erfolgt nur wenig an der Zinkelektrode, weil sie dort gehemmt ist: Wasserstoff hat an Zink eine deutlich größere Überspannung als an Kupfer oder Silber.
Durch den vertikalen Aufbau erhöht sich der Pressdruck der aufeinander gestapelten Metallplatten und mit Elektrolyt getränkten weichen Papp- oder Lederstücke von oben nach unten, wenn keine Abstandshalter eingesetzt werden. Volta experimentierte auch mit einzelnen voneinander getrennten Bechern für je eine Zelle, die er in Serie schaltete.[7] Die technische Weiterentwicklung der Volta’schen Säule aus dem Jahr 1802, die den Nachteil des Stapels vermeidet, ist zum Beispiel die Trog-Batterie von William Cruickshank. Auch heutige Batterien werden aus separaten Zellen zusammengesetzt.
Reaktionsgleichungen
[Bearbeiten | Quelltext bearbeiten]Bei allen Batterien mit Zinkelektrode geht dieses bei der Entladung in Lösung:
Auf Kupferstücken befindet sich immer eine Schicht aus Oxidationsprodukten wie z. B. Kupferoxiden, wenn das Kupfer Luftkontakt hatte. Somit gibt es an der Oberfläche Kupferionen, die entladen werden können:
Im Daniell-Element laufen zwar dieselben Reaktionen ab, aber wesentlich länger, da in diesem durch Zugabe von Kupfersalzen ein sehr viel größerer Vorrat an Kupferionen vorhanden ist. In der Voltasäule sind diese bald verbraucht. Dann läuft an der Kupferelektrode vor allem die Reaktion
ab. Sie liefert aber eine geringere Spannung. Als Gesamtreaktion ergibt sich
- .
In geringerem Maße ist an der Kupferelektrode auch eine Reaktion des Luftsauerstoffs gemäß
möglich, insbesondere wenn der Elektrolyt einer frisch aufgebauten Säule mit Luft gesättigt ist. Da sich der Sauerstoff verbraucht und nur langsam ins Innere der Zelle nachdiffundiert, ist diese Reaktion bei längerem Betrieb der Zelle und größeren Strömen von untergeordneter Bedeutung. Dennoch verbraucht die Säule der Reaktionsgleichung entsprechend während des Betriebs Sauerstoff der umgebenden Luft.[8] Sauerstoff trägt dazu bei, die Wirksamkeit der Säule zu erhöhen.[8] Andererseits ist Sauerstoff aber zur Wirksamkeit der Säule entbehrlich[8], da statt der Sauerstoffreduktion auch die oben angegebene Wasserstoffentwicklung erfolgen kann. Sauerstoff kann aber auch Zink aus den Zinkelektroden durch Korrosion verbrauchen und sie so zerstören:
Weblinks
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- Bern Dibner: Alessandro Volta and the electric battery. Verlag F. Watts, 1964, LCCN 64-011915, S. 135 (eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Alexander Volta: On the Electricity excited by the mere Contact of conducting Substances of different kinds. In a Letter from Mr. Alexander Volta, F. R. S. Professor of Natural Philosophy in the University of Pavia, to the Rt. Hon. Sir Joseph Banks Bart. K. B. P. R. S. Read June 26, 1800. In: Royal Society (Hrsg.): Philosophical Transactions of the Royal Society of London. Band 90, Nr. 2 (Part II). W. Bulmer, 1800, ISSN 0261-0523, OCLC 7134330, XVII: Philosophical Transactions, S. 403–431, doi:10.1098/rstl.1800.0018, JSTOR:107060 (französisch, ia600307.us.archive.org [PDF; 3,7 MB; abgerufen am 17. Juli 2016] angegebenes Briefdatum: 20. März 1800): « mon premier appareil a colonne […] les plateaux métalliques […] l’appareil d'un nombre tres-grand de plateaux, au-dela, par exemple, de 60, 80, 100 […] »
- ↑ Alexander Volta: On the Electricity excited by the Mere Contact of Conducting Substances of Different Kinds. In a Letter from Mr. Alexander Volta, F.R.S. Professor of Natural Philosophy in the University of Pavia, to the Rt. Hon. Sir Joseph Banks Bart. K.B. P.R.S. Read June 26, 1800. In: Royal Society of London (Hrsg.): Abstracts of the Papers Printed in the Philosophical Transactions of the Royal Society of London. From 1800 to 1830 inclusive. 1 (1800 to 1814). Richard Taylor, London 1832, S. 27–29, JSTOR:109515 (englisch, biodiversitylibrary.org [abgerufen am 17. Juli 2016] französisch: ds. 1800.): “The object of the present paper is to describe this apparatus […] It consists of a long series of alternate succession of three conducting substances, either copper, tin and water; or, what is much preferable, silver, zinc, and a solution of any neutral or alkaline salt.”
- ↑ Franco Decker: Electrochemistry Encyclopedia. Case Western Reserve University, Januar 2005, Volta and the 'Pile' (englisch, electrochem.cwru.edu ( des vom 16. Juli 2012 im Internet Archive)).
- ↑ Colin Russell: Enterprise and electrolysis... In: Chemistry World. 1. August 2003, abgerufen am 4. Januar 2024 (englisch).
- ↑ a b Leopold Franz Herrmann: System der practischen Arzeneymittellehre. Erster Band, Allgemeine Arzeneymittellehre. Band 1. Ghelen, Wien 1824, I. Hauptstück, § 7. Physische Heilmittel, S. 25–26 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 15. Juli 2016] Zitiert werden u. a. Arbeiten von Karl Johann Christian Grapengiesser Berlin 1801, Franz Heinrich Martens 1803 und J. A. Heidemann Wien 1808): „bedeutende Lücken […] gestattet nur eine beschränktere willkührliche Anwendung mancher derselben zum Behufe des Heilgeschäftes.“
- ↑ Joh. Anton Heidmann: Resultate aus meinen Versuchen mit der zusammengesetzten ungleichartigen Metallverbindung, oder mit der Voltaschen Säule. In: Ludwig Wilhelm Gilbert (Hrsg.): Annalen der Physik. Band 10, Nr. 1. Renger, Halle 1802, S. 50–56, doi:10.1002/andp.18020100105 (online bei Gallica [abgerufen am 24. Juli 2016]): „aus der Anwendung des verstärkten Galvanismus an erst verblichenen Menschen die leichteste und zuverlässigste Bestimmung des wahren Todes und die Unterscheidung desselben vom Scheintode erwarten lässt“
- ↑ a b c d https://www.gutenberg.org/files/57952/57952-0.txt Friedricht Dannemann: Die Naturwissenschaften in ihrer Entwicklung und in ihrem Zusammenhange, Ditter Band: Das Emporblühen der modernen Naturwissenschaften bis zur Entdeckung Des Energieprinzipes, Verlag Wilhelm Engelmann, Leipzig 1911
- ↑ a b c Jean-Baptiste Biot, Frédéric Cuvier: Ueber das Verschlucken des Sauerstoffgas durch die Voltaische Säule. In: Ludwig Wilhelm Gilbert (Hrsg.): Annalen der Physik. Band 10, Nr. 2. Renger, Halle 1802, S. 161–165, doi:10.1002/andp.18020100203 (online bei Gallica): „Man sieht aus diesem Versuche, dass der Sauerstoff, den die Säule der atmosphärischen Luft entzieht, dazu beiträgt, die Wirksamkeit der Säule zu verstärken. […] Wir schließen daraus, dass die Voltaische Säule eine eigenthümliche, von der äussern Luft unabhängige Wirksamkeit besitzt.“