Schwefeloxidtetrafluorid
(Weitergeleitet von Thionyltetrafluorid)
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
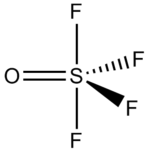
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Schwefeloxidtetrafluorid | ||||||||||||
| Andere Namen |
Thionyltetrafluorid | ||||||||||||
| Summenformel | F4OS | ||||||||||||
| Kurzbeschreibung |
farbloses, stechend riechendes Gas[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 124,06 g·mol−1 | ||||||||||||
| Aggregatzustand |
gasförmig[1] | ||||||||||||
| Dichte | |||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
−48,5 °C[1] | ||||||||||||
| Löslichkeit |
reagiert mit Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Schwefeloxidtetrafluorid ist eine chemische Verbindung aus der Gruppe der Fluoride.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Schwefeloxidtetrafluorid kann durch Reaktion von Thionylfluorid mit Brompentafluorid bei 280 °C[1] oder durch Umsetzung von Thionylfluorid mit Fluor[3] gewonnen werden.
Ebenfalls möglich ist die Darstellung durch Reaktion von Schwefeltetrafluorid mit Sauerstoff bei 200 °C und Stickstoffdioxid als Katalysator.[1]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Schwefeloxidtetrafluorid ist ein farbloses, stechend riechendes Gas. Es reagiert mit Wasser unter starker Wärmeentwicklung zu Sulfurylfluorid und Fluorwasserstoff[3]:
Natronlauge absorbiert es völlig.[1]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i j Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 187.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b John K. Ruff: Thionyl tetrafluoride and pentafluorosulfur hypofluorite. In: William L. Jolly (Hrsg.): Inorganic Syntheses. Band 11. McGraw-Hill Book Company, Inc., 1968, S. 131–137 (englisch).



