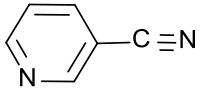
3-Cyanpyridin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 3-Cyanpyridin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H4N2 | |||||||||||||||
| Kurzbeschreibung |
weißer bis beiger, kristalliner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 104,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
48–52 °C[2] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck |
0,296 mm Hg (25 °C)[2] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,4460–1,4490 (20 °C, 589 nm)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
3-Cyanpyridin ist eine wichtige Vorstufe für Nicotinaldehyd, Nicotinsäure (Niacin) und Nicotinsäureamid (Niacinamid), sowie für Pflanzenschutzmittel, wie z. B. das Insektizid Pymetrozin.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Pyridin-3-sulfonsäure (aus Pyridin und Schwefeltrioxid in Gegenwart von Quecksilber(II)-sulfat bei 235 °C in Ausbeuten von >90 % erhältlich) reagiert nach Neutralisation mit Natronlauge als Natriumsalz beim Erhitzen mit Gemischen von Natriumcyanid und Kaliumcyanid in 45%iger Ausbeute zu 3-Cyanpyridin.[6][7]
Der nucleophile Austausch des Broms in 3-Brompyridin (durch Bromierung mit der ionischen Flüssigkeit N-Octylchinolinium-tribromid in 91%iger Ausbeute)[8] durch Cyanid aus Kupfer(I)-cyanid liefert Nicotinonitril in 67%iger Ausbeute.[9]
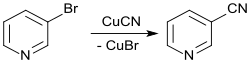
Wesentlich bessere Ausbeuten (93 %) erzielt die Umsetzung in Gegenwart der Organopalladiumverbindung Pd2(dba)3 [Tris(dibenzylidenaceton)dipalladium(0)], dem Phosphin t-Bu3P (Tri-tert. Butylphosphin) und Tributylzinnchlorid in Acetonitril bei 80 °C.[10]
Acrylnitril dimerisiert in einer Kopf-Schwanz-Anordnung z. B. in Gegenwart von Tricyclohexylphosphin PCy3 in 77%iger Ausbeute zu 2-Methylenglutarnitril (2,4-Dicyano-1-buten),[11] das nach Chlorierung zum 2-Chlor-2-chlormethylglutaronitril mit Lewis-Säuren, wie z. B. Zinn(IV)-chlorid oder Aluminiumchlorid zu 3-Cyanpyridin reagiert.[4]

Die oxidative Ammonolyse von Nikotin und seinen Nebenalkaloiden Nornikotin, Nicotyrin, Anabasin, Anatabin und Myosmin aus Tabakabfällen erzeugt mit Vanadium(V)-oxid/Titandioxid-Katalysatoren mit Ammoniak und Wasserstoffperoxid bei 420 °C Nicotinonitril in Ausbeuten bis 60 %.[12]

Die angegebenen Synthesewege eignen sich wegen teurer Edukte und Reagentien, geringen Ausbeuten und hohem apparativem Aufwand nicht für eine technische Synthese von 3-Cyanpyridin.
Durch Umsetzung von Nikotinsäure mit Diphosphortetraiodid/Ammoniumcarbonat kann Nicotinonitril in 88%iger Ausbeute,[13] mit Kupfer(I)-chlorid und dem Silylierungsmittel MSTFA (N-Methyl-N-(trimethylsilyl)trifluoracetamid) in 96%iger Ausbeute erhalten werden.[14]

Die Wasserabspaltung aus Nicotinsäureamid mittels Phosphorpentoxid erzeugt 3-CP in 83- bis 84%iger Ausbeute,[15] mit dem Schwefeltrioxid-Triethylamin-Komplex werden Ausbeuten von 95 % erzielt.[16]
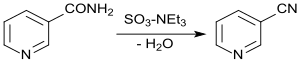
Auf dieser Reaktion beruht auch die ältere Variante der 3-Cyanpyridinsynthese der Lonza AG.[17]
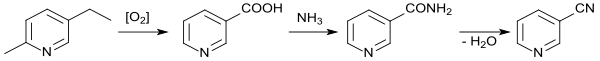
In industriellem Maßstab hat sich neben der Dehydratisierung von Nicotinamid vor allem die Ammonoxidation von 3-Picolin in der Dampfphase[18] durchgesetzt. Dazu werden meist so genannte VPO-Katalysatoren, basierend auf Vanadium(V)-oxid und Phosphorpentoxid verwendet, die mit Übergangsmetalloxiden dotiert sind, wie z. B. Molybdän,[19][20] Titan,[21] mit Zusatz von Zirkon[22] oder Eisen.[23]

Die Ammonoxidation von 3-Methylpyridin ist hinsichtlich Katalysatorzusammensetzung, Reaktionszeit und Reaktionstemperatur (340–440 °C), Druck (Normaldruck) und der Zusammensetzung des Gemischs aus 3-Picolin, Ammoniak, Luft bzw. Sauerstoff und Wasser auf möglichst hohen Umsatz (bis 100 %), Selektivität (bis 100 %) und Ausbeute (>95 %) optimiert.
Eine moderne Syntheseroute startet mit 2-Methylpentan-1,5-diamin – einem Nebenprodukt der Adiponitrilsynthese (durch Hydrierung des durch Addition von HCN an die 2-Position von 1,3-Butadien statt an die erwünschte 1-Position erhaltenen sekundären Dinitrils), das zu 3-Methylpiperidin cyclisiert und zum 3-Methylpyridin dehydriert wird.[24][22]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]3-Cyanpyridin ist ein weißer bis bernsteinfarbener Feststoff, der einen stechenden Geruch aufweist.[3] Die Verbindung löst sich in Wasser und in vielen organischen Lösungsmitteln und kann aus Petrolether zur Reinigung umkristallisiert werden.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Hydrierung von Nicotinonitril in verdünnter Essigsäure mit Raney-Nickel als Katalysator mit Reaktionsabbruch nach Aufnahme der theoretischen Menge an Wasserstoff liefert in 93%iger Ausbeute Nicotinaldehyd, eine Schlüsselkomponente für die Synthese des Insektizids Pymetrozin.[25]
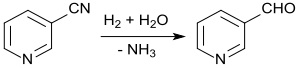
In einem neueren Verfahren wird Pymetrozin in einer Eintopfreaktion direkt aus 3-Cyanpyridin und dem Aminotriazinon bei der Hydrierung mit Raney-Nickel in Essigsäure mit 98%iger Ausbeute erhalten.[26]
Vollständige Hydrierung von Nicotinonitril in verdünnter Salzsäure mit Palladium auf Aktivkohle als Katalysator erzeugt 3-Aminomethylpyridin-hydrochlorid, das mit Ethylnitrit diazotiert und anschließend zum Nicotinylalkohol (3-Pyridinmethanol) verkocht werden kann.[27]

Bei der Umsetzung von Nicotinonitril mit der Grignard-Verbindung n-Propylmagnesiumbromid entsteht in 40%iger Ausbeute 3-Pyridyl-n-propylketon, das in einer Wolff-Kishner-Reaktion in 60%iger Ausbeute zum 3-n-Butylpyridin hydriert werden kann.[28]

Synthese der Vitamin B3-Formen Nicotinsäure (Niacin) und Nicotinamid (Niacinamid)
[Bearbeiten | Quelltext bearbeiten]Die weitaus wichtigste Verwendung von Nicotinsäurenitril liegt in der Umsetzung zur Nicotinsäure und insbesondere zum Nicotinsäureamid.
Die vollständige chemische Hydrolyse von 3-Cyanpyridin mit konzentrierten Laugen führt zu Natriumnicotinat, aus dem mit Salzsäure die freie Nicotinsäure in 97%iger Ausbeute und in hoher Reinheit erhalten wird.[29]
Die enzymatische Hydrolyse mit Nitrilase liefert bei bis 100%igem Umsatz direkt reine Nicotinsäure aus Nicotinonitril.[30]
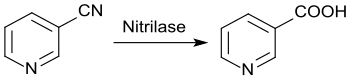
Die überwiegend industriell genutzten Alternativrouten zur chemischen Darstellung von Nicotinsäure[31] – die Oxidation von 3-Picolin mit konzentrierter Salpetersäure bzw. mit Sauerstoff an einem Vanadiumpentoxid-Kontakt oder die Oxidation von 2-Methyl-5-ethylpyridin (aus Acetaldehyd und Ammoniak) mit Salpetersäure – können von den Herstellern meist je nach Verfügbarkeit und Preis der Rohstoffe variiert werden.
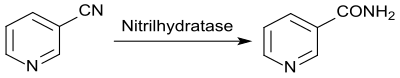
Bei der partiellen chemischen Hydrolyse von 3-Cyanpyridin entsteht Nicotinsäureamid,[32] das aber meist 3–5 % Nicotinsäure als schwer abtrennbare Verunreinigung enthält, die bei der Gabe als Vitamin bei Nutztieren Durchfall verursachen kann, statt das Wachstum zu unterstützen.[33]
Dagegen liefert die enzymatische Hydrolyse mit der Nitrilhydratase von immobilisierten Zellen des Wildtyps Rhodococcus rhodochrous J1 als Biokatalysator in mehrstufigen Enzymreaktoren mit >99,3 % Selektivität bei 100%igem Umsatz hochreines Nicotinamid.[34] Dabei können Produktkonzentrationen von 1,465 g/l erzielt werden, wobei das feste Edukt Nicotinonitril bei der Hydrolyse allmählich solubilisiert wird und das Produkt (Nicotinamid) bei höheren Konzentrationen auskristallisiert, d. h. das Medium ist zu Beginn und Ende der Reaktion fest.[35]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b W.M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, Boca Raton, FL, U.S.A. 2012, ISBN 978-1-4398-8049-4, S. 3–474.
- ↑ a b c d e f g h Datenblatt 3-Pyridinecarbonitrile bei Sigma-Aldrich, abgerufen am 10. Mai 2017 (PDF).
- ↑ a b c 3-Cyanopyridine, Safety Data Sheet. (PDF; 150 kB) In: vertellus.com. Vertellus Holdings LLC, ehemals im (nicht mehr online verfügbar); abgerufen am 11. Mai 2017 (englisch). (Seite nicht mehr abrufbar. Suche in Webarchiven)
- ↑ a b Patent US3644380: Preparation of 3-cyanopyridin. Angemeldet am 24. November 1969, veröffentlicht am 22. Februar 1972, Anmelder: Merck & Co., Erfinder: R. Harmetz, R.J. Tull.
- ↑ a b Eintrag zu 3-Cyanopyridine bei TCI Europe, abgerufen am 10. Mai 2017.
- ↑ S.M. McElvain, M.A. Goese: The sulfonation of pyridine and the picolines. In: J. Am. Chem. Soc. Band 65, Nr. 11, 1943, S. 2233–2236, doi:10.1021/ja01251a063.
- ↑ Patent US2409806: Synthesis of nicotinic compounds. Angemeldet am 8. Dezember 1941, veröffentlicht am 22. Oktober 1946, Anmelder: Pittsburgh Coke & Chemical Co., Erfinder: W. Shive, R.A. Glenn.
- ↑ M.P. Kaushik, V. Polshettiwar: N-octylquinolinium tribromide: A task specific quinoline based ionic liquid as a new brominating agent. In: Ind. J. Chem. 45B, 2006, S. 2542–2545 (res.in [PDF]).
- ↑ Patent US2491253: Preparation of nicotinonitrile. Angemeldet am 9. August 1944, veröffentlicht am 13. Dezember 1949, Anmelder: American Cyanamide Co., Erfinder: M.L. Crossley, V.L. King, E.H. Northey, T.F. Scholz.
- ↑ C. Yang, J.M. Williams: Palladium-catalyzed cyanation of aryl bromides promoted by low-level organotin compounds. In: Org. Lett. Band 6, Nr. 17, 2004, S. 2837–2840, doi:10.1021/ol049621d.
- ↑ L. Yu et al.: Practical and scalable preparation of 2-methyleneglutaronitrile via an efficient and highly selective head-to-tail dimerization of acrylonitrile catalysed by low-loading of tricyclohexylphosphine. In: RSC Adv. Band 4, 2014, S. 19122–19126, doi:10.1039/C4RA02810D.
- ↑ A. Kagarlitskii, M. Iskakova, A. Turmukhambetov: Catalytic conversion of nicotine into nicotinonitrile – a pharmaceutical intermediate product. In: Pharm. Chem. J. Band 36, Nr. 1, 2002, S. 26–27, doi:10.1023/A:1015796724195.
- ↑ V.N. Telvekar, R.A. Rane: A novel system for the synthesis of nitriles from carboxylic acids. In: Tetrahedron Lett. Band 48, Nr. 34, 2007, S. 6051–6053, doi:10.1016/tetlett.2007.06.108.
- ↑ S. Enthaler, M. Weidauer: Copper-catalyzed dehydration of primary amides to nitriles. In: Catalysis Lett. Band 141, Nr. 8, 2011, S. 1079–1085, doi:10.1007/s10562-011-0660-9.
- ↑ P.C. Teague, W.A. Short: Nicotinonitrile In: Organic Syntheses. 33, 1953, S. 52, doi:10.15227/orgsyn.033.0052; Coll. Vol. 4, 1963, S. 706 (PDF).
- ↑ Patent US5817827: Method for the dehydration of amides to nitriles. Angemeldet am 22. Oktober 1996, veröffentlicht am 6. Oktober 1998, Anmelder: Hoffmann-La Roche Inc., Erfinder: W. Bonrath, H. Pauling.
- ↑ Nutrition – Niacin and Niacinamide. (PDF; 546 kB) In: ethorn.com. Lonza AG Consumer Care, abgerufen am 20. Mai 2017 (englisch).
- ↑ V.N. Kalevaru, B.D. Raju, V.V. Rao, A. Martin: Ammonoxidation of 3-picoline over V2O5/MgF2 catalysts: Correlations between nicotinonitrile yield and O2 and NH3 chemisorption properties. In: Catalysis Commun. Band 9, Nr. 5, 2008, S. 715–720, doi:10.1016/j.catcom.2007.08.009.
- ↑ Patent US2510605: Production of nitriles. Angemeldet am 6. April 1946, veröffentlicht am 6. Juni 1950, Anmelder: Allied Chemical & Dye Corp., Erfinder: F. Porter, M. Erchak, J.N. Cosby.
- ↑ Patent EP2305377A1: Catalysts for the preparation of cyanopyridines and their use. Angemeldet am 29. September 2009, veröffentlicht am 6. April 2011, Anmelder: Lonza Ltd., Polynt S.A., Erfinder: A. Zenklusen, D. Pianzola, R. Laenza, G. Mazzoni, E. Armbruster, R. Chuck.
- ↑ V.N. Kalevaru, N.N. Madaan, A. Martin: Synthesis, characterization and catalytic performance of titania supported VPO catalysts for the ammoxidation of 3-picoline. In: Appl. Catalysis A: General. Band 391, Nr. 1–2, 2011, S. 52–62, doi:10.1016/j.apcata.2010.07.034.
- ↑ a b Patent US5719045: Process for preparing nicotinamide. Angemeldet am 31. Oktober 1996, veröffentlicht am 17. Februar 1998, Anmelder: Lonza AG, Erfinder: J. Heveling, E. Armbruster, L. Utiger, M. Rohner, H.-R. Dettwiler, R.J. Chuck.
- ↑ Patent US7795169B2: Process for preparing cyanopyridines and suitable catalysts therefor. Angemeldet am 30. Juli 2004, veröffentlicht am 14. September 2010, Anmelder: Vertellus Specialties Inc., Erfinder: A. Fischer, A. Martin, B. Lucke, V. Kalevaru, C. Weckbecker, K. Huthmacher.
- ↑ Patent US5714610: Process for the preparation of 3-methylpiperidine and 3-methylpyridine by catalytic cyclization of 2-methyl-1,5-diaminopentane. Angemeldet am 30. März 1994, veröffentlicht am 3. Februar 1998, Anmelder: Lonza Ltd., Erfinder: J. Heveling, E. Armbruster, W. Siegrist.
- ↑ Patent US5646288: Process for the preparation of aqueous nicotinaldehyde. Angemeldet am 2. Juni 1995, veröffentlicht am 8. Juli 1997, Anmelder: Ciba-Geigy Corp., Erfinder: U. Siegrist, H. Szczepanski.
- ↑ Patent EP0613895B1: Process for the preparation of 6-alkyl-4-(pyridin-3-yl-methylenamino)-4,5-dihydro-1,2,4-triazin-3(2H)-one. Angemeldet am 21. Februar 1994, veröffentlicht am 28. Oktober 1998, Anmelder: Novartis AG, Erfinder: T. Pitterna, U. Siegrist, H. Szczepanski.
- ↑ Patent US2615896: Preparation of 3-pyridyl-carbinol. Angemeldet am 20. Januar 1950, veröffentlicht am 28. Oktober 1952, Anmelder: Hoffmann-La Roche Inc., Erfinder: G.O. Chase.
- ↑ R.L. Frank, C. Weatherbee: Pyridines.III.3-n-butylpyridine and an unusual alkylation it its synthesis. In: J. Am. Chem. Soc. Band 70, Nr. 10, 1948, S. 3482–3483, doi:10.1021/ja01190a081.
- ↑ Patent EP0242535A2: Verfahren zur Herstellung grobkristalliner Nicotinsäure. Angemeldet am 24. Februar 1987, veröffentlicht am 28. Oktober 1987, Anmelder: Degussa AG, Erfinder: A. Möller, H. Friedrich, H. Kuhn, K. Winkler.
- ↑ C.D. Mathew, T. Nagasawa, M. Kobayashi, H. Yamada: Nitrilase-catalyzed production of nicotinic acid from 3-cyanopyridine in Rhodococcus rhodochrous J1. In: Appl. Environ. Microbiol. Band 54, Nr. 4, 1988, S. 1030–1032, PMC 202591 (freier Volltext).
- ↑ M. Baumann, I.R. Baxendale: An overview of the synthetic routes to the best selling drugs containing 6-membered heterocycles. In: Beilstein J. Org. Chem. Band 9, 2013, S. 2265–2319, doi:10.3762/bjoc.9.265 (beilstein-journals.org).
- ↑ C.F. Krewson, J.F. Couch: The hydrolysis of nicotinonitrile by ammonia. In: J. Am. Chem. Soc. Band 65, Nr. 11, 1943, S. 2256–2257, doi:10.1021/ja01251a505.
- ↑ A.S. Bommarius, B.R. Riebel: Biocatalysis – Fundamentals and Applications. Wiley-VCH, Weinheim 2004, ISBN 978-3-527-30344-1, S. 162.
- ↑ T. Nagasawa, C.D. Mathew, J. Mauger, H. Yamada: Nitrilase hydratase-catalyzed production of nicotinamide from 3-cyanopyridine in Rhodococcus rhodochrous J1. In: Appl. Environ. Microbiol. Band 54, Nr. 7, 1988, S. 1766–1769, PMC 202743 (freier Volltext).
- ↑ A. Liese, K. Seelbach, C. Wandrey (Hrsg.): Industrial Biotransformations, 2nd ed. Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31001-2, S. 484.

