Aminobacter
| Aminobacter | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Aminobacter | ||||||||||||
| (den Dooren de Jong 1926) Urakami et al. 1992 |
Aminobacter ist eine Gattung von Bakterien. Die Arten können methylotroph wachsen, d. h. sie können Verbindungen mit einem (einzigen) Kohlenstoff-Atom (C1-Verbindungen) wie z. B. Methylamin (CH5N) als Kohlenstoffquelle für ihr Wachstum nutzen. Auch umweltschädliche und giftige Verbindungen wie Brommethan können von den Bakterien verwertet werden.[1]
Merkmale
[Bearbeiten | Quelltext bearbeiten]Die Zellen sind stäbchenförmig, mit einer Größe von 0,5–0,9 × 1,0–3,0 µm. Sie treten einzeln oder selten auch paarweise auf.Aminobacter ist durch subpolare liegende Flagellen beweglich. Sporen werden nicht gebildet. Die Fortpflanzung erfolgt durch Knospung.[2]
Stoffwechsel und Wachstum
[Bearbeiten | Quelltext bearbeiten]Die Arten von Aminobacter benötigen Sauerstoff (aerob), der Stoffwechselweg ist die Atmung. Eine Art ist auch in der Lage, unter Sauerstoffausschluss Nitrat zu nutzen (Nitratamtung).
Die Zellen zeigen gutes Wachstum, z. B. in Hefeextrakt-Pepton-Glucose Agar. Als Speicherstoff wird Poly-β-hydroxybuttersäure-Granulat innerhalb der Zellen gebildet. Der Methylrot- und der Voges-Proskauer-Test verlaufen negativ. Indol und Schwefelwasserstoff (H2S) werden nicht produziert. Gelatine und Stärke werden nicht hydrolysiert. Die Zellen bilden Ammoniak. Als Kohlenstoffquellen werden z. B. Polysaccharide verwendet. Methanol, Methan und Wasserstoff werden nicht verwendet.
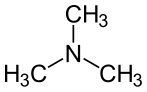

Als Stickstoffquellen werden z. B. Ammoniak, Nitrat, Harnstoff, Pepton und Methylamin genutzt. Arten von Aminobacter sind fakultativ methylotroph. Sie sind in der Lage, Verbindungen mit nur einem C-Atom als Energie- und Kohlenstoffquelle zu nutzen.[3] Zu den Verbindungen zählen z. B. Monomethylamin, Trimethylamin und Trimethylamin-N-oxid.[2]
Das vorherrschende Chinon ist Ubichinon-10.[2]
Systematik
[Bearbeiten | Quelltext bearbeiten]Die Typusart Aminobacter aminovorans wurde zuerst von Dooren de Jong im Jahr 1926 beschrieben, der diese Art noch als Pseudomonas aminovorans bezeichnete. Isoliert wurde die Art aus Bodenproben, die mit verschiedenen Aminen wie Methylamin, Trimethylamin, Tetramethylammonium (TMAH), Ethylamin und Ethylharnstoff angereichert waren. Der Artname „aminovorans“ weist auf die Fähigkeit der Art, verschiedene Amine als Kohlenstoff- und Energiequelle zu nutzen. Die Gattung zählt zu der Familie Phyllobacteriaceae des Phylums Pseudomonadota (auch als Proteobacteria bezeichnet).
Aminobacter umfasst auch die Art Chelatobacter heintzii, welche als späteres Synonym von Aminobacter aminovorans angesehen wird.[4]
Es folgt eine Liste einiger Arten:[5]
- Aminobacter aganoensis Urakami et al. 1992
- Aminobacter aminovorans (den Dooren de Jong 1926) Urakami et al. 1992
- Aminobacter anthyllidis Maynaud et al. 2013
- Aminobacter carboxidus (Meyer et al. 1994 ex Nozhevnikova and Zavarzin 1974) Hördt et al. 2020
- Aminobacter ciceronei McDonald et al. 2005
- Aminobacter niigataensis Urakami et al. 1992
Ökologie
[Bearbeiten | Quelltext bearbeiten]Arten von Aminobacter können Ökosysteme besiedeln, die giftige Verbindungen wie Pestizide, Trichlorethylen, Halogenverbindungen oder Arsen enthalten. Die Arten Aminobacter lissarensis, A. aminovorans und A. anthyllidis zeigen auch eine Toleranz gegenüber Zink- und Cadmium-Verbindungen.[1]
Zu den Halogenverbindungen, die Aminobacter-Arten als Energie- und Kohlenstoffquelle nutzen, zählen Chlormethan, Brommethan und Iodmethan. Halogenierte organische Verbindungen gehören zu industriell wichtigen Lösungsmitteln, Bausteinen für chemische Synthesen und Pestiziden. Viele dieser Verbindungen bleiben in der Umwelt und sind daher zu Umweltschadstoffen geworden. Hierzu zählen v. a. chlorierten Insektizide.[6] Chlormethan ist der am häufigsten vorkommende Halogenkohlenstoff in der Atmosphäre und wird neben der industriellen Nutzung auch auf natürlichen Wege gebildet, hauptsächlich von Meeresalgen und holzabbauenden Pilzen. Auch bei Verbrennung von Biomasse entsteht Chlormethan.[7][8][6]Aminobacter lissarensis ist in der Lage, Chlormethan (CH3Cl) als einzige Kohlenstoff- und Energiequelle zu nutzen. Der Stamm wurde aus den obersten 5 cm des Bodens in einem Buchenwald in der nordirischen Grafschaft Down isoliert.
Brommethan wird wie auch Chlormethan durch natürliche Prozesse freigesetzt, aber auch die Verwendung von synthetisch hergestellten Brommethan zur Schädlingsbekämpfung in der Landwirtschaft trug erheblich zu den jährlichen Emissionen bei, bis seine Verwendung durch das Montrealer Protokoll eingeschränkt wurde.[6] Aminobacter ciceronei wurde aus mit Brommethan (CH3Br) belasteten Boden isoliert. Die Anreicherung des Stammes wurde auf einem Mineralsalzmedium unter einer modifizierten Atmosphäre aus Luft und CH3Br als einzige Kohlenstoff- und Energiequelle durchgeführt (Miller et al. 1997). Aminobacter ciceronei kann diese Verbindung durch den methylotrophen Stoffwechsel nutzen. Des Weiteren kann A. ciceronei auch Iodmethan nutzen.[9][10] Diese Verbindung ist toxisch und gilt als Krebserreger. Andere Arten, die Halogenverbindungen durch den methylotrophen Stoffwechsel nutzen können, sind z. B. Arten von Methylobacterium und Leisingeria.[11]
A. anthyllidis LMG 26462T kann Stickstoff aus der Atmosphäre fixieren. Es bildet hierbei mit der Pflanze Echter Wundklee (Anthyllis vulneraria) eine Symbiose (Knöllchenbakterien).[1][9] In der Klasse Alphaproteobacteria sind relativ wenige stickstofffixierende Gattung vertreten. Neben Aminobacter anthyllidis zählen hierzu z. B. Ensifer, Bradyrhizobium, Mesorhizobium, Rhizobium, Methylobacterium, Azorhizobium, Ochrobactrum, Shinella, Phyllobacterium und Devosia.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Géraldine Maynaud, Anne Willems, Souhir Soussou, Céline Vidal, Lucette Mauré, Lionel Moulin, Jean-Claude Cleyet-Marel, Brigitte Brunel: Molecular and phenotypic characterization of strains nodulating Anthyllis vulneraria in mine tailings, and proposal of Aminobacter anthyllidis sp. nov., the first definition of Aminobacter as legume-nodulating bacteria. In: Systematic and Applied Microbiology. Band 35, Nr. 2, März 2012, S. 65–72, doi:10.1016/j.syapm.2011.11.002 (englisch, elsevier.com [abgerufen am 5. Dezember 2023]).
- ↑ a b c Bergey's Manual of Systematics of Archaea and Bacteria. 1. Auflage. Wiley, 2015, ISBN 978-1-118-96060-8, doi:10.1002/9781118960608.gbm00835.
- ↑ Irene Artuso, Paolo Turrini, Mattia Pirolo, Gabriele Andrea Lugli, Marco Ventura, Paolo Visca: Phylogenomic Reconstruction and Metabolic Potential of the Genus Aminobacter. In: Microorganisms. Band 9, Nr. 6, 19. Juni 2021, ISSN 2076-2607, S. 1332, doi:10.3390/microorganisms9061332, PMID 34205374, PMC 8235418 (freier Volltext) – (englisch, mdpi.com [abgerufen am 24. November 2023]).
- ↑ LPSN
- ↑ Aminobacter
- ↑ a b c S. Fetzner: Aerobic Degradation of Halogenated Aliphatics. In: Handbook of Hydrocarbon and Lipid Microbiology. Springer Berlin Heidelberg, Berlin, Heidelberg 2010, ISBN 978-3-540-77584-3, S. 865–885, doi:10.1007/978-3-540-77587-4_62 (englisch).
- ↑ I. R. McDonald, K. L. Warner, C. McAnulla, C. A. Woodall, R. S. Oremland, J. C. Murrell: A review of bacterial methyl halide degradation: biochemistry, genetics and molecular ecology. In: Environmental Microbiology. Band 4, Nr. 4, April 2002, ISSN 1462-2912, S. 193–203, doi:10.1046/j.1462-2920.2002.00290.x (englisch).
- ↑ Hendrik Schäfer, Laurence G. Miller, Ronald S. Oremland, J. Colin Murrell: Bacterial Cycling of Methyl Halides. In: Advances in Applied Microbiology. Band 61. Elsevier, 2007, ISBN 978-0-12-002663-0, S. 307–346, doi:10.1016/s0065-2164(06)61009-5 (englisch, elsevier.com [abgerufen am 29. November 2023]).
- ↑ a b Francisco J. Escaray, Ana B. Menendez, Andrés Gárriz, Fernando L. Pieckenstain, María J. Estrella, Luis N. Castagno, Pedro Carrasco, Juan Sanjuán, Oscar A. Ruiz: Ecological and agronomic importance of the plant genus Lotus. Its application in grassland sustainability and the amelioration of constrained and contaminated soils. In: Plant Science. Band 182, Januar 2012, S. 121–133, doi:10.1016/j.plantsci.2011.03.016 (englisch, elsevier.com [abgerufen am 3. Dezember 2023]).
- ↑ Ian R. McDonald, Peter Kämpfer, Ed Topp, Karen L. Warner, Michael J. Cox, Tracy L. Connell Hancock, Laurence G. Miller, Michael J. Larkin, Veronique Ducrocq, Catherine Coulter, David B. Harper, J. Colin Murrell, Ronald S. Oremland: Aminobacter ciceronei sp. nov. and Aminobacter lissarensis sp. nov., isolated from various terrestrial environments. In: International Journal of Systematic and Evolutionary Microbiology. Band 55, Nr. 5, 1. September 2005, ISSN 1466-5026, S. 1827–1832, doi:10.1099/ijs.0.63716-0 (englisch).
- ↑ D. P. Kelly, A. P. Wood: Isolation and Characterization of Methanotrophs and Methylotrophs: Diversity of Methylotrophic Organisms and of One-Carbon Substrates. In: Handbook of Hydrocarbon and Lipid Microbiology. Springer Berlin Heidelberg, Berlin, Heidelberg 2010, ISBN 978-3-540-77584-3, S. 3827–3845, doi:10.1007/978-3-540-77587-4_300 (englisch).