Baeyer-Indol-Synthese
Die Baeyer-Indol-Synthese oder Baeyer-Emmerling-Indolsynthese ist eine Namensreaktion der organischen Chemie. Sie ist die Synthese von Indolen aus ortho-Nitrozimtsäure. Dabei kommt es zu einer alkalischen Reduktion der Nitrogruppe durch Eisen.[1]
Von der Reaktion wurde das erste Mal 1869 von den deutschen Chemikern Adolf von Baeyer (1835–1917) und Adolph Emmerling (1842–1906) berichtet.[2]
Übersichtsreaktion
[Bearbeiten | Quelltext bearbeiten]Bei der Synthese kommt es zur Reduktion der (E)-o-Nitrozimtsäure (trans-o-Nitrozimtsäure). Als Produkt wird Indol erhalten:

Die Reaktion funktioniert analog mit (Z)-o-Nitrozimtsäure (cis-o-Nitrozimtsäure).
Die blau markierte Bindung im Produkt ist die neu geknüpfte Kohlenstoff-Stickstoff-Bindung, die zum Ringschluss führt.
Reaktionsmechanismus
[Bearbeiten | Quelltext bearbeiten]Der nachfolgende Reaktionsmechanismus wird in der Literatur[1] beschrieben:
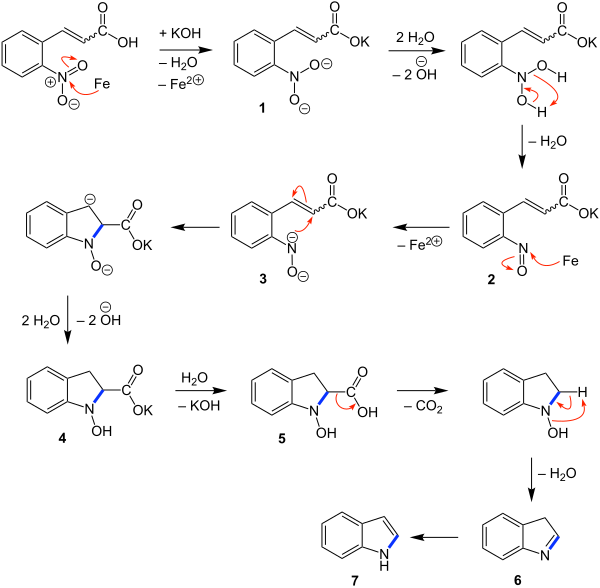
Zunächst wird die o-Nitrozimtsäure durch das Eisen reduziert. Zudem kommt es zur Bildung eines Kaliumsalzes, als Zwischenstufe wird das Anion 1 erhalten. Im zweiten Schritt kommt es zur Protonierung, wobei die Protonen aus den Wassermolekülen stammen. Durch die darauffolgende Wasserabspaltung wird die Nitrosoverbindung 2 gebildet. Danach kommt es zu einer weiteren Reduktion durch Eisen. In dem Anion 3 führen Elektronenumlagerungen zum Ringschluss. Durch die danach folgende Protonierung wird die Zwischenstufe 4 erhalten. In dieser kommt es durch ein Wassermolekül zur Rückbildung der Carboxygruppe und es bildet sich die Carbonsäure 5. Durch Elektronenumlagerungen folgt in den nächsten beiden Schritten die Abspaltung eines Kohlenstoffdioxid- und Wassermoleküls, wodurch das Molekül 6 gebildet wird. Im letzten Schritt kommt es zur Isomerisierung und als Produkt wird Indol 7 erhalten.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Zerong Wang: Comprehensive Organic Name Reactions and Reagents, Wiley, 2010, ISBN 978-0-470-63885-9, S. 140–143, doi:10.1002/9780470638859.
- ↑ A. Baeyer und A. Emmerling: Synthese des Indols In: Berichte der deutschen chemischen Gesellschaft. 2, 1869, S. 679–682, doi:10.1002/cber.186900201268.