Bemetizid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
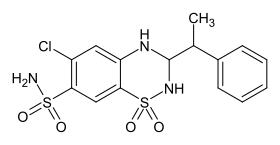
| |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bemetizid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C15H16ClN3O4S2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Wirkmechanismus |
Hemmung des NaCl-Cotransporters | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 401,03 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt |
235–236 °C[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Bemetizid ist eine chemische Verbindung aus der Gruppe der Heterocyclen und ein Diuretikum vom Thiazidtyp. Die chemische Struktur enthält unter anderem ein Aminal als funktionelle Gruppe.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Bemetizid wurde erstmals 1961 von John G. Topliss et al. synthetisiert. Sein Vorschlag war konsekutiver Art und bediente sich der Edukte Chloraminophenamid und 2-Phenylpropionaldehyd. Diese mussten lediglich gemeinsam in ethanolischem Chlorwasserstoff 1–2 h zum Rückfluss erhitzt werden um das Produkt zu erhalten. Zur Isolation wurde die Lösung etwas aufkonzentriert und Chloroform hinzugegeben. Dann wurde wieder aufkonzentriert bis sich ein Niederschlag bildete. Ab hier wurde die Lösung gekühlt, sodass restlicher Feststoff ausfiel und gesammelt werden konnte.[4] Das Produkt kann aus Ethylacetat / Hexan umkristallisiert werden, um es zu reinigen.[1]

Aus den Synthesevarianten resultiert ein Isomerengemisch.
Stereochemie
[Bearbeiten | Quelltext bearbeiten]Das Molekül enthält zwei chirale C-Atome. Somit resultieren vier verschiedene Stereoisomere.

Eine Auftrennung der Isomeren ist mittels chromatographischer Methoden möglich.[5] Blaschke et al. fanden ein Diastereomerenverhältnis von 5:1.[6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bemetizid ist eine feste kristalline Substanz, die in zwei polymorphen Formen auftritt.[7] Ein zwischen 224 °C und 232 °C schmelzendes Polymorph bildet lange Nadeln, das zwischen 230 °C und 236 °C schmelzende Polymorph viereckige Blättchen.[8]
Bemetizid ist ein Diuretikum aus der Gruppe der Thiazide und bewirkt wie andere Vertreter dieser Stoffgruppe eine vermehrte Ausscheidung von Elektrolyten und damit einhergehend durch das osmotisch gebundene Wasser einen vermehrten Harnfluss. Die Wirkung entsteht im frühdistalen Nierentubulus durch die verringerte Rückresorption von Natrium-Ionen aus dem Tubuluslumen über die Hemmung des Na+/Cl--Cotransporters.[9] Die Wirkung erreicht nach etwa 2 bis 3 Stunden ihr Maximum und hält in Abhängigkeit von der Dosis 6 bis 12 Stunden an. Die terminale Halbwerteszeit beträgt 3 bis 6 Stunden.[9]
Therapeutische Verwendung
[Bearbeiten | Quelltext bearbeiten]Angewendet wird Bemetizid peroral zur Langzeitbehandlung von Bluthochdruck, bei chronischer systolischer Herzinsuffizienz mit Flüssigkeitsretention und bei kardialen, hepatischen und nephrogenen Ödemen[9] und wird dazu mit dem ebenfalls harntreibend wirksamen Triamteren kombiniert.
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]- Kombination mit Triamteren: Dehydro comp (D)[10], Dehydro sanol tri (D)[11], Diucomb (D)[11]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Patent US3163645A: Derivatives of 3,4-dihydro-2-h-[1,2,4]-benzothiadiazine-1,1-dioxides. Angemeldet am 25. September 1964, veröffentlicht am 29. Dezember 1964, Anmelder: Ciba Geigy Corp, Erfinder: George De Stevens, Lincoln Harvey Werner.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances – Synthesis, Patents, Applications. 4. Auflage. Thieme-Verlag, Stuttgart 2000, ISBN 1-58890-031-2.
- ↑ J. G. Topliss, M. H. Sherlock, F. H. Clarke, M. C. Daly, B. W. Pettersen, J. Lipski, N. Sperber: 3-Substituted Dihydrobenzothiadiazine 1, 1-Dioxides as Diuretic Agents1. In: The Journal of Organic Chemistry. Band 26, Nr. 10, 1961, S. 3842–3850, doi:10.1021/jo01068a053.
- ↑ B. Visegrady, T. Konecsni, N. Grobuschek, M.G. Schmid, F. Kilar, H.Y. Aboul-Enein, G. Gübitz: Chiral separation of thiazide diuretics by HPLC on Chiralcel OD-RH®, Chiralcel OJ-R® and Chirobiotic-TTM® phases. Journal of Biochemical and Biophysical Methods, Bd. 53, 2002, S. 15–24, doi:10.1016/S0165-022X(02)00088-X.
- ↑ G. Blaschke, J. Maibaum: Enantiomers of Benzothiadiazine Diuretics by Direct Chromatographic Resolution of the Racemic Drugs. Journal of Pharmaceutical Sciences, Bd. 74, 1985, S. 438–442, doi:10.1002/jps.2600740414.
- ↑ J. Klosa; H. Voigt: Über eine einfache Synthese von Dihydrobenzothiadiazindioxydderivaten. Journal für praktische Chemie, Bd. 16, 1962, S. 264–276, doi:10.1002/prac.19620160505.
- ↑ M. Kuhnert-Brandstätter; A. Kofler; A. Vlachopoulos; A. Lobenwein: Beitrag zur mikroskopischen Charakterisierung und Identifizierung von Arzneimitteln unter Einbeziehung der UV-Spektroskopie. Scientia Pharmaceutica, Bd. 38, 1970, S. 154–163.
- ↑ a b c G. Geisslinger, S. Menzel, T. Gundermann, B. Hinz, P. Roth (Hrsg.): Mutschler Arzneimittelwirkungen. 11. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2020, S. 605 ff.
- ↑ dehydro® comp. In: ROTE LISTE. Archiviert vom am 6. Juni 2022; abgerufen am 6. Juni 2022.
- ↑ a b E. Brunner, M. Dassinger, I. Grohmann, B. Jung, A. Kuhlmann, M. Löwe, A. Pfleger, A. Schwinn, C. Selz, S. Sieprath, K. Sy: ROTE LISTE 2010. Hrsg.: Rote Liste® Service GmbH. 55. Auflage. Rote Liste® Service GmbH, Frankfurt am Main 2010, ISBN 978-3-939192-40-4, S. 1029.