Benutzer:Kas1989/Halogenierung
Als Halogenierung wird in der Chemie die Überführung eines Elementes oder einer Verbindung in ein Halogenid, eine salzartige oder kovalent aufgebaute Verbindung mit einem Halogen, bezeichnet. Dies ist sowohl für anorganische als auch organische Verbindungen möglich. Je nach Halogen wird zwischen Fluorierung, Chlorierung, Bromierung oder Iodierung unterschieden.
Additionsreaktionen
[Bearbeiten | Quelltext bearbeiten]Halogen, Halogenwasserstoff oder hypohalogenige Säure reagieren mit ungesättigten Verbindungen.
Addition von Halogenen an Alkene oder Alkine
[Bearbeiten | Quelltext bearbeiten]Aus Alkenen entstehen durch die Umsetzung mit Halogenmolekülen vicinale Dihalogenalkane. Alkine addieren Halogen schrittweise. Es entstehen Tetrahalogenalkane.[1] Hier am Beispiel der Reaktion von Br2 mit Ethin dargestellt:

Der erste Schritt ist die Bildung des vicinalen Dihalogenalkens (hier 1,2-Dibromethen).
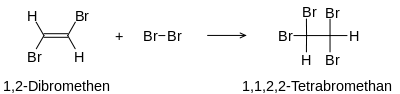
Im zweiten Schritt entsteht das Tetrahalogenalkan (hier 1,1,2,2-Tetrabromethan)
Addition von Halogenwasserstoff an Alkene oder Alkine
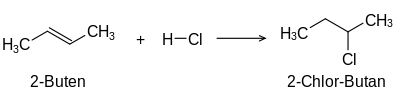
[Bearbeiten | Quelltext bearbeiten]Die Addition von Halogenwasserstoff an ein Alken liefert ein Monohalogenalkan. Alkine reagieren mit Halogenwasserstoff zu einem Monohalogenalken, wobei das Halogenatom an eines der zwei sp2-hybridisierten Kohlenstoffatomorbitale der Kohlenstoff-Kohlenstoff-Doppelbindung addiert wird.[2] Ein Beispiel für die Addition von Halogenwasserstoffen an Alkene ist die Chlorierung von 2-Buten:
Addition von hypohalogeniger Säure an Alkene
[Bearbeiten | Quelltext bearbeiten]Die Addition von hypohalogeniger Säure an Alkene liefert Halogenhydrine, d. h. beide sp2-hybridisierten Kohlenstoffatome im Edukt wandeln sich in sp3-hybridisierten Kohlenstoffatome im Produkt um, in dem an eines dieser Kohlenstoffatome ein Hydroxy-Rest und an das andere ein Halogenatom gebunden wird.[3]
Addition von Halogenen an freie Radikale
[Bearbeiten | Quelltext bearbeiten]Wegen der leichten homolytischen Spaltung von Halogenmolekülen reagieren diese spontan mit freien organischen Radikalen.
Substitutionsreaktionen
[Bearbeiten | Quelltext bearbeiten]Halogenierung von Aromaten
[Bearbeiten | Quelltext bearbeiten]Eine Variante um Aromaten zu halogenieren ist die elektrophile aromatische Substitution. Hierbei greifen aktivierte Halogenide das aromatische System elektrophil an. Ein Beispiel hierfür ist die Chlorierung von Benzol:
- Lässt man Chlor in Gegenwart einer Lewis-Säure mit Benzol reagieren, entstehen Chlorbenzol und Chlorwasserstoff. FeCl3 oder Aluminiumtrichlorid fungiert dabei meist als Lewis-Säure und dient der Aktivierung von Chlor, das andernfalls nicht mit Benzol reagieren würde.
Die Reaktion mit Brom würde analog verlaufen.[4][5]
Halogenierung von Alkanen
[Bearbeiten | Quelltext bearbeiten]Die Halogenierung von Alkanen läuft radikalisch ab und führt zu Halogenalkanen.[6]
- Radikalische Substitution von Ethan mit Cl2
Halogenierung in der Allyl-Stellung oder Benzyl-Stellung
[Bearbeiten | Quelltext bearbeiten]Die Halogenierung von Alkenen in Allyl-Stellung[7] oder von Alkylaromaten in der Benzyl-Stellung[8] läuft radikalisch ab und führt unter Substitution zu halogenierten Alkenen bzw. in der Seitenkette halogenierten Alkylaromaten.
Halogenierung von Ketonen und Aldehyden
[Bearbeiten | Quelltext bearbeiten]Die Halogenierung von Ketonen ist formal eine elektrophile Substitutionsreaktion mit einem Proton als Abgangsgruppe. Sie verläuft jedoch nicht nach einem derartigen Mechanismus sondern über das Enol des betreffenden Ketons und es entstehen α-halogenierte Ketone.[9] Die Halogenierung von Aldehyden verläuft analog.[4][5]

Mechanismus der Halogenierung von Aldehyden und Ketonen
[Bearbeiten | Quelltext bearbeiten]Die Halogenierung von Carbonylgruppen, wie sie an Aldehyden und Ketonen vorhanden sind, kann entweder säure- oder basenkatalysiert ablaufen. Im Folgenden wird der Mechanismus exemplarisch anhand einer säurekatalytischen Bromierung von Aceton demonstriert:

Das eingesetzte Aceton (1) steht mit seiner Enolform über die Keto-Enol-Tautomerie im Gleichgewicht. Setzt man nun Brom hinzu, so lagert sich dieses wie beschrieben an die Enolform an und es bildet sich das Oxoniumion 2, welches eine weitere mesomere Grenzstruktur besitzt. Außerdem bildet sich ein Bromion, welches im folgenden Schritt das Oxoniumion 2 deprotoniert. Dadurch erhält man einfach bromiertes Aceton 3. Wiederholt man diese Schritte zweimal für dieses bromierte Aceton 3, so kann man ein dreifach bromiertes Aceton 4 erhalten. Man spricht dann von einem α,α,α-trihalogeniertem Aceton.
Der geschwindigkeitsbestimmende Schritt bei dieser Reaktion ist die Bildung des Enols. Die Reaktionsgeschwindigkeit nimmt mit jedem dem Molekül zugefügten Halogen ab, da die Halogene elektronenziehend sind. Dadurch erschweren sie die Umlagerung von Elektronen im Molekül zur Enolform. Man sagt auch, dass die Enolisierbarkeit der Verbindung gesenkt wurde.[4]
Halogenierung von Carbonsäuren
[Bearbeiten | Quelltext bearbeiten]Carbonsäuren lassen sich durch Umsetzung mit Thionylchlorid in Carbonsäurechloride umwandeln. Andere Chlorierungsmittel, wie z. B. Phosphortrichlorid oder Phosphorpentachlorid können ebenfalls eingesetzt werden.[2]
- Beispiel einer Bromierung nach Hell-Volhard-Zelinsky
Halogenierung von Ethern
[Bearbeiten | Quelltext bearbeiten]Ether sind bei tiefen Temperaturen zu α-Chlor- und α,α'-Dichlorethern chlorierbar.[10]
Substitution von Hydroxygruppen
[Bearbeiten | Quelltext bearbeiten]Hydroxygruppen in Alkoholen werden mittels Chlorwasserstoff durch Chlor bzw. mittels Bromwasserstoff durch Brom substituiert.[10] Insbesondere für primäre und sekundäre Alkohole werden häufig Thionylchlorid (SOCl2) zur Chlorierung und Phosphortribromid (PBr3) zur Bromierung verwendet. Um Hydroxygruppen durch Iod zu substituieren wird neben Iodwasserstoff im Labor auch Phosphortriiodid, welches in situ aus Phosphor und Iod hergestellt wird, verwendet.
Substitution des Sauerstoffs von Carbonylgruppen
[Bearbeiten | Quelltext bearbeiten]Beim Erhitzen von Aldehyden oder Ketonen mit Phosphortrichlorid oder Phosphortribromid entstehen geminale Dichloride bzw. Dibromide.[11]
Substitution von stickstoffhaltigen Gruppen durch Halogen
[Bearbeiten | Quelltext bearbeiten]Reaktion von Diazoniumsalzen unter Bildung von organischen Halogenverbindungen. Neben der Sandmeyer-Reaktion ist hier die Balz-Schiemann-Reaktion von Bedeutung.[11]
Halogenierung am Stickstoffatom von Carbonsäureamiden
[Bearbeiten | Quelltext bearbeiten]Carbonsäureamide, die am Amidstickstoffatom mindestens ein Wasserstoffatom tragen, reagieren mit Hypohalogeniten. Es entstehen N-Halogencarbonsäureamide. Ein Beispiel ist N-Bromsuccinimid (NBS), das man in wässeriger Lösung aus Succinimid und je einem Equivalent einer Base und Brom erhält.[12]
Halogenierung in der anorganischen Chemie
[Bearbeiten | Quelltext bearbeiten]In der anorganischen Chemie spielt die Halogenierung unter anderem zur Bildung von Salzen, Halogenwasserstoffen und Halogensauerstoffsäuren eine Rolle.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Marye Anne Fox, James K. Whitesell: Organische Chemie, Grundlagen, Mechanismen, bioorganische Anwendungen, Spektrum, Akad. Verl., 1995, ISBN 3-86025-249-6.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 517.
- ↑ a b Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 73, ISBN 3-7776-0406-2. Referenzfehler: Ungültiges
<ref>-Tag. Der Name „Beyer“ wurde mehrere Male mit einem unterschiedlichen Inhalt definiert. - ↑ Siegfried Hauptmann: Reaktion und Mechanismus in der organischen Chemie, B. G. Teubner, Stuttgart, 1991, S. 113, ISBN 3-519-03515-4.
- ↑ a b c d K. Peter C. Vollhardt, Neil E. Schore, "Organische Chemie", Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, 2005, 4.Auflage, H. Butenschön, ISBN 3-527-31380-X, S.779-783. Referenzfehler: Ungültiges
<ref>-Tag. Der Name „Vollhardt“ wurde mehrere Male mit einem unterschiedlichen Inhalt definiert. - ↑ a b Paula Yurkanis Bruice: Organic Chemistry. 4. Auflage, Prentice-Hall, 2003, ISBN 0-131-41010-5, S. 607-609. Referenzfehler: Ungültiges
<ref>-Tag. Der Name „Bruice“ wurde mehrere Male mit einem unterschiedlichen Inhalt definiert. - ↑ Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie, Springer-Verlag, 1972, S. 297−306, ISBN 3-211-81060-9.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 240, ISBN 3-342-00280-8.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 297, ISBN 3-342-00280-8.
- ↑ Siegfried Hauptmann: Reaktion und Mechanismus in der organischen Chemie, B. G. Teubner, Stuttgart, 1991, S. 95−96 und S. 136, ISBN 3-519-03515-4.
- ↑ a b Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 518.
- ↑ a b Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 519.
- ↑ Norman L. Allinger, Michael P. Cava, Don C. de Jongh, Carl R. Johnson, Norman A. Lebel, Calvin L. Stevens: Organische Chemie, Walter de Gruyter & Co., 1980, S. 898, ISBN 3-11-004594-X.
Weblinks
[Bearbeiten | Quelltext bearbeiten][[Kategorie:Chemische Reaktion]]


![{\displaystyle \mathrm {R} {-}CH_{2}{-}COOH\ {\xrightarrow[{2.\ H_{2}O}]{1.\ PBr_{3},\ Br_{2}}}\ R{-}CHBr{-}COOH\ +\ HBr}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0f78dbc2968c2697eb78b5a48d1248de509b4c73)