Certoparin
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
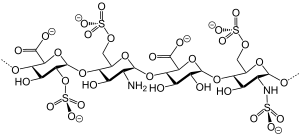
| |||||||||
| Darstellung eines Ausschnitts aus der Struktur von Heparin[1] ohne Darstellung der Gegenionen (Natrium) | |||||||||
| Allgemeines | |||||||||
| Name | Certoparin | ||||||||
| CAS-Nummer | 9041-08-1 | ||||||||
| Monomere/Teilstrukturen | abwechselnd D-Glucosamin und D-Glucuronsäure oder L-Iduronsäure | ||||||||
| Molmassenabschätzung |
4200 – 6200 g·mol−1 | ||||||||
| ATC-Code | |||||||||
| DrugBank | DB09261 | ||||||||
| Kurzbeschreibung |
beiger Feststoff[2] | ||||||||
| Arzneistoffangaben | |||||||||
| Wirkstoffklasse |
| ||||||||
| Wirkmechanismus |
Hemmt antithrombinabhängig die Gerinnungsfaktoren Xa und in geringerem Ausmaß Faktor IIa (Thrombin) | ||||||||
| Eigenschaften | |||||||||
| Aggregatzustand |
fest[2] | ||||||||
| Löslichkeit |
löslich in Wasser (50 g·l−1 bei 20 °C)[2] | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Toxikologische Daten | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Certoparin ist ein Arzneistoff zur Hemmung der Blutgerinnung. Es gehört zur Gruppe der niedermolekularen Heparine (NMH). Certoparin hat ein breites Anwendungsspektrum zur Prophylaxe und Therapie von tiefen Venenthrombosen (TVT) und wird unabhängig vom Thromboserisiko, der Nierenfunktion und dem Körpergewicht in fixen Standarddosierungen eingesetzt. Während der Hämodialyse kann es zur Antikoagulation bei extrakorporalem Kreislauf eingesetzt werden. Das im Handel befindliche Präparat wird in Europa produziert und ist in Deutschland zugelassen.
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]Certoparin wird durch Depolymerisation aus unfraktioniertem Heparin gewonnen.[3] Es hat ein Molekulargewicht im Bereich von 4200 bis 6200 Dalton. Im Vergleich zu unfraktioniertem Heparin (UFH) hat Certoparin ein deutlich höheres Verhältnis von anti-Xa- zu anti-IIa-Aktivität (im Mittel etwa 2,2). Die überwiegende Hemmwirkung auf den Faktor Xa wird über Antithrombin vermittelt (ca. 100 I.E. anti-Xa/mg). Die aktivierte partielle Thromboplastinzeit (aPTT) wird nur geringfügig beeinflusst. In den zur Prophylaxe verwendeten Dosen werden die Standardgerinnungstests nur unwesentlich beeinflusst. In therapeutischen Dosen führt es zu einer Verlängerung der Gerinnungszeit beim Heptest bzw. zu einer Erhöhung der anti-Xa-Aktivität im Plasma.
Die pharmakokinetischen Parameter von Certoparin werden (indirekt) über die Messung der anti-Xa-Aktivität im Plasma bestimmt. Eine direkte Korrelation der anti-Xa-Aktivität mit der antithrombotischen Wirksamkeit ist jedoch nicht gegeben. Eine Gerinnungsüberwachung ist in der Regel nicht erforderlich.[3][4][5]
Subkutan appliziertes Certoparin wird rasch resorbiert, die anti-Xa-Aktivität erreicht nach 2 bis 4 Stunden ihr Maximum.[3][4] Die Halbwertszeit (t ½) der Hemmung des Faktor Xa bei einer einmaligen Gabe von 3.000 I.E. Certoparin-Natrium subkutan beträgt im Median 4,3 Stunden. Im Vergleich liegt der Median des UFH bei 2,2 Stunden. Die Bioverfügbarkeit von Certoparin beträgt etwa 90 %.[6] Die Metabolisierung findet hauptsächlich in der Leber statt.
Bei Patienten mit schwerer Niereninsuffizienz wird empfohlen, die Dosis individuell auf der Basis von anti-Xa-Bestimmungen anzupassen.[4]
Eine antikörpervermittelte Thrombozytopenie (HIT Typ II) tritt unter Certoparin nur selten auf.[3][4]
Anwendung
[Bearbeiten | Quelltext bearbeiten]Certoparin wird in je fixer Dosierung in der Prophylaxe venöser thromboembolischer Ereignisse und in der Therapie tiefer Venenthrombosen angewendet. Es wird subkutan, am häufigsten im Bauchbereich, gespritzt. Die intramuskuläre Anwendung ist kontraindiziert.
In der Dialysebehandlung wird eine Certoparin wird zu Beginn als Einmaldosis intravenös verabreicht; die Bolusgabe kann mit einer Infusion von 600 I.E./Stunde in den arteriellen Schenkel ergänzt werden.
Bei Blutungen kann Protamin als Antidot eingesetzt werden.[7] Die Überleitung von direkten oralen Antikoagulantien (DOAK) auf Certoparin ist möglich. Eine allgemeine Anleitung findet sich in der Leitlinie der European Heart Rhythm Association (EHRA).[8] Umgekehrt ist auch die Überleitung von der Certoparin-Therapie zur oralen Weiterbehandlung möglich.[4]
Indikationen
[Bearbeiten | Quelltext bearbeiten]Certoparin hat ein breites Anwendungsspektrum mit Zulassungen in folgenden Indikationen:[3][4]
Prophylaxe von tiefen Venenthrombosen bzw. thromboembolischer Ereignissen
[Bearbeiten | Quelltext bearbeiten]Für die Prophylaxe von tiefen Venenthrombosen bzw. thromboembolischer Ereignisse:
- Allgemeinchirurgie: Peri- und postoperative Primärprophylaxe tiefer Venenthrombosen bei Patienten mit mittlerem thromboembolischen Risiko
- Orthopädische Chirurgie: Peri- und postoperative Primärprophylaxe tiefer Venenthrombosen mit hohem thromboembolischen Risiko
- Innere Medizin: Prophylaxe venöser thromboembolischer Ereignisse (VTE) bei nicht-chirurgischen Patienten mit einem erhöhten Risiko für VTE und bei Immobilisation aufgrund einer akuten Erkrankung wie beispielsweise akute Atemwegserkrankungen, Herz- und Gefäßerkrankungen, akute infektiöse bzw. entzündliche Erkrankungen, gastrointestinale Erkrankungen oder neurologische Erkrankungen
- Neurologie: Primärprophylaxe venöser thromboembolischer Ereignisse bei Patienten mit akutem ischämischem Schlaganfall (Certoparin besitzt als einziges NMH diese Indikation).
- Hämodialyse: Antikoagulation bei extrakorporalem Kreislauf während der Hämodialyse
Therapie von tiefen Venenthrombosen
[Bearbeiten | Quelltext bearbeiten]Eine Lungenembolie kann mit Certoparin behandelt werden, wenn gleichzeitig eine TVT besteht.
Certoparin kann sowohl in der Prophylaxe wie auch in der Therapie der VTE bei Niereninsuffizienz eingesetzt werden. Bei Patienten mit schwerer Beeinträchtigung der Nierenfunktion ist der Wirkstoff mit Vorsicht (Prophylaxe) bzw. besonderer Vorsicht (Therapie) angewendet werden.[3][4]
Klinische Studien
[Bearbeiten | Quelltext bearbeiten]Certoparin wurde 1989 erstmals zugelassen und seitdem breit angewendet.[9] Die Zulassungen in den oben genannten Indikationen basieren auf den Daten umfangreicher klinischer Studien.
Die wichtigsten in den Fachinformationen genannten Studien[3][4] sind in der Tabelle zusammengefasst:
| Akronym | Indikation | Design | n | Primärer Endpunkt | Outcomes | Quelle |
|---|---|---|---|---|---|---|
| PROPHYLAXE Certoparin 1-mal täglich 3000 IE | ||||||
| PROTECT | Akuter ischämischer Schlaganfall | MC, DB, R | 545 | Symptomatische oder asymptomatische proximale TVT, symptomatische LE oder Tod in Verbindung mit einer VTE | Certoparin gleich wirksam wie UFH; kombinierter Endpunkt 18,7 % unter Certoparin vs. 19,7 % unter UFH. Blutungskomplikationen in beiden Gruppen mit 3,7 % identisch (schwere Blutungen 1,1 % vs. 1,8). Certoparin ist vergleichbar wirksam wie UFH in der VTE-Prophylaxe. | [10] |
| CERTIFY | Nicht-chirurgische Patienten mit eingeschränkter Mobilität aufgrund einer akuten Erkrankung | MC, DB, R | 3239 | Proximale TVT, symptomatische nicht fatale Lungenembolie, Tod in Zusammenhang mit VTE | Certoparin war dem UFH 3 × 5000 IE täglich signifikant nicht unterlegen (3,9 % vs. 4,5 %, p = 0,0001). Jegliche Blutungen waren unter Certoparin reduziert (3,2 % vs. 4,6 %, p = <0,05). | [11] |
| THERAPIE Certoparin 2-mal täglich 8000 IE für 10–14 Tage | ||||||
| NMH-TH-3 | Akute proximale TVT | MC, R, O | 538 | Marder Score | Marder Score unter Certoparin zu Beginn 26,5 ± 8,3 und nach der Behandlung 19,8 ± 9,9. Marder Score unter UFH: zu Beginn 24,2 ± 8,2 und nach der Behandlung 21,4 ± 9,7 (p = 0.18). | [12] |
| NMH-TH-4 | Akute proximale TVT | MC, R | 1220 | Symptomatisches Rezidiv, symptomatische nicht-tödliche Lungenembolie, Thrombolysen, Lungenembolien, Tod von VTE (Ausschlussdiagnose) | Certoparin bei thromboembolischen Komplikationen nicht unterlegen UFH (3,8 % Certoparin versus 4,3 % UFH). Blutungskomplikationen in der Initialphase (0,3 % vs. 0,4 %) und während des Follow-up (2,4 % vs. 4,0 %, p<0,05) niedriger bei Certoparin. | [12][13] |
Abkürzungen: n= Zahl der Patienten. MC= multizentrisch, R= randomisiert, DB= doppelblind, O= offen
Gegenanzeigen
[Bearbeiten | Quelltext bearbeiten]Certoparin darf, wie andere niedermolekulare Heparine auch, nicht angewendet werden bei: Überempfindlichkeit gegen das Wirkstoffgemisch und/oder Heparin, bei aktueller oder aus der Anamnese bekannter immunologisch bedingter Thrombozytopenie (Typ II) auf Heparin, Blutungsneigung, akuten oder kurz zurückliegenden Blutungen (u. a. im Gehirn, Augen). Weitere Gegenanzeigen sind Magen-Darm-Geschwüre, unkontrollierbarer schwerer Hypertonie, schwere Beeinträchtigung der Leberfunktion, Endokarditis.[3][4]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2, S. 345.
- ↑ a b c d e f Datenblatt Heparin Natriumsalz aus Schweinedarm bei Sigma-Aldrich, abgerufen am 8. Juli 2024 (PDF).
- ↑ a b c d e f g h Fachinformation Mono-Embolex Prophylaxe Sicherheitsspritze 3000 IE. Viatris GmbH. Stand April 2022. [Internet]. [cited 2024 Mar 22];Available from: [1]
- ↑ a b c d e f g h i Fachinformation Mono-Embolex Therapie Sicherheitsspritze 8000 IE. Viatris GmbH. Stand April 2022. [Internet]. [cited 2024 Mar 22];Available from: [2]
- ↑ Jeske W, Wolf H, Ahsan A, Fareed J. Pharmacologic profile of certoparin. Expert Opin Investig Drugs 1999;8(3):315–27.
- ↑ Haas S, Bramlage P. Die Erfolgsgeschichte von niedermolekularem Heparin. Vasomed 2015;25(3):116–22
- ↑ Harenberg J, Giese C, Knödler A, Zimmermann R, Schettler G. Antagonisierung von niedermolekularem Heparin durch Protaminchlorid. Herz/Kreislauf 1986;18:578–81.
- ↑ Steffel J, Collins R, Antz M, et al. 2021 European Heart Rhythm Association Practical Guide on the Use of Non-Vitamin K Antagonist Oral Anticoagulants in Patients with Atrial Fibrillation. Europace 2021;23(10):1612–76.
- ↑ Donadini MP, Ageno W, Guasti L, Squizzato A. Certoparin for the treatment and prevention of thrombosis: pharmacological profile and results from clinical studies. Expert Opin Drug Metab Toxicol 2013;9(7):901–9.
- ↑ Diener H-C, Ringelstein EB, von Kummer R, et al. Prophylaxis of thrombotic and embolic events in acute ischemic stroke with the low-molecular-weight heparin certoparin: results of the PROTECT Trial. Stroke 2006;37(1):139–44.
- ↑ Riess H, Haas S, Tebbe U, et al. A randomized, double-blind study of certoparin vs. unfractionated heparin to prevent venous thromboembolic events in acutely ill, non-surgical patients: CERTIFY Study. J Thromb Haemost 2010;8(6):1209–15
- ↑ a b Riess H, Becker LK, Melzer N, Harenberg J. Treatment of deep vein thrombosis in patients with pulmonary embolism: subgroup analysis on the efficacy and safety of certoparin vs. unfractionated heparin. Blood Coagul Fibrinolysis 2014;25(8):838–44.
- ↑ a b Harenberg J, Riess H, Büller HR, Brom J, Weidinger G, Huisman MV. Comparison of six-month outcome of patients initially treated for acute deep vein thrombosis with a low molecular weight heparin Certoparin at a fixed, body-weight-independent dosage or unfractionated heparin. Haematologica 2003;88(10):1157–62.