Formine
| Formin 1 | ||
|---|---|---|
| Andere Namen |
FMN 1 | |
| Bezeichner | ||
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Formin 2 | ||
|---|---|---|
| Andere Namen |
FMN 2 | |
| Bezeichner | ||
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
Formine bezeichnet eine Gruppe von Proteinen, die vor allem an der Aktinnukleation beteiligt sind, das Aktin und das Mikrotubuli-Zytoskelett regulieren[1] und darüber hinaus an verschiedenen, unterschiedlichen Zellfunktionen wie Zellmigration oder Cytokinese beteiligt sind.[2]
Formen und Struktur
[Bearbeiten | Quelltext bearbeiten]
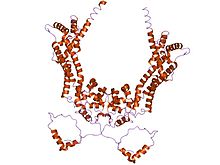
Allgemein handelt es sich bei Forminen um bis zu 2000 Aminosäuren lange Multidomänen-Proteine, die durch die Anwesenheit der drei Domänen FH1 („formin homology domain 1“), FH2 und FH3 charakterisiert sind. Allerdings müssen nicht zwingend alle drei Domänen vorhanden sein, damit ein Protein zu den Forminen zählt. So enthält beispielsweise das Formin ForC, das in Dictyostelium discoideum vorkommt, keine FH1-Domäne.[3] Diese FH1-Domäne ist reich an Prolin, und kann deswegen mit Profilin und SH3-Domänen oder WW-Motiven anderer Proteine interagieren. Die sichelförmige FH2-Domäne ermöglicht es den Forminen sich mit sich selbst zu verbinden, da FH2-Domänen aneinander binden können,[4] und besteht aus drei helikalen Unterdomänen.[5] Die FH3-Domäne ist weniger gut konserviert und scheint wichtig für die Lokalisation der Formine in der Zelle. Darüber hinaus können Formine noch über eine GBD („GTPase-Bindungsdomäne“) und eine C-terminale DAD („Diaphanous-Autoregulatorische Domäne“) verfügen,[6] die eine Rolle bei der Regulation von Formin spielen.
Formin kommt in allen Eukaryoten vor. Auf diese geht evolutionär wohl auch die FH2-Domäne zurück.[7]
Formin wurde 1990 bei Untersuchungen an Mäusen gefunden, die an Deformationen ihrer Gliedmaßen (engl. „limb deformaty (LD)“), allgemeinen Gewebeschäden und variabel auftretender Aplasie litten. Richard P. Woychik und andere konnten dafür die Mutationen an einem komplexen Gen verantwortlich machen, das sie wegen seiner großen Bedeutung für die Form der Gliedmaßen „Formin“ nannten.[8][9]
Funktion
[Bearbeiten | Quelltext bearbeiten]Regulation des Aktinzytoskeletts
[Bearbeiten | Quelltext bearbeiten]Formine sind auf vielfältige Weise an der Bildung und Regulation des Aktinzytoskeletts beteiligt. Die hochkonservierte FH2-Domäne des Formins und der damit verbundene Linker zur FH1-Domäne sind nötig, um die Dimerisierung von G-Aktin und seine Nukleation zu F-Aktin in vitro zu stabilisieren. Ein möglicher Grund für diese Stabilisierung ist die Tatsache, dass die FH2-Domäne zwei Aktinmoleküle ähnlich der Bindung in F-Aktin bindet. Die FH1-Domäne agiert dagegen mit Profilin und kann daher ATP-Aktin aus dem Profilin-G-Aktin-Komplex rekrutieren und so die Nukleation ebenfalls fördern. Daneben ist die FH2-Domäne des Formins auch ein wirksamer Gegenspieler zu sogenannten „capping“-Proteinen; das sind Proteine, die durch ihre Anlagerung an die Plusenden des Aktins die Nukleation hemmen und die im Gegensatz zu Formin die kritische Aktinkonzentration erhöhen.
Zum genaueren Ablauf wurde das durch verschiedene Beobachtungen gestützte „leaky“/„processive cappers“-Model entwickelt, das postuliert, das Formine fortlaufend mit dem Plusende des Aktinfilaments assoziiert und verbunden bleiben. Neue G-Aktin Elemente werden dabei zwischen die FH2-Domäne des Formins und dem Filament eingebaut; dabei üben die Formine eine Kraft von einem Piconewton pro Aktinfilament aus.
Beteiligung an der Bildung von Filopodien
[Bearbeiten | Quelltext bearbeiten]Um die Beteiligung der Formine an der Bildung von Filopodien zu erklären, gibt es das „convergent elongation model of filopdia formation“. Es besagt, dass F-Aktin, das durch den Arp 2/3-Komplex nukleiert und verkappt wurde, selektiv wieder elongiert wird und sich zu Bündeln aneinanderlagert. Diese Bündel drücken schließlich gegen die Plasmamembran der Zelle und führen zur Bildung der Filopodia. Die Entfernung der Verkappung am F-Aktin wird dabei durch Proteine der Ena/VASP-Familie bewerkstelligt, von denen zwingend beide für eine funktionierende Filopdienbildung benötigt werden. Für die selektive Elongation des F-Aktins sind aber wahrscheinlich Formine verantwortlich, wie Untersuchungen nahelegen.
Regulierung der Formine
[Bearbeiten | Quelltext bearbeiten]Für die Regulierung der Formine sind wohl Rho-GTPasen – molekulare Schalter vielfältiger Signaltransduktionsprozesse – zuständig. In Drosophila konnte der Mechanismus gut nachvollzogen werden: Wird die FH1- und FH2-Domäne von der GBD-Domäne (N-terminale GTPase Bindungsdomäne) und der DAD (Diaphanous autoregulatorische Domäne) flankiert, so ist Formin gehemmt. Diese Hemmung wird aufgehoben, wenn die GTPase GTP bindet und so aktiviert wird. In diesem aktivierten Zustand kann die GTPase an die GBD-Domäne binden und so den inhibitorischen Komplex um Formin auflösen.
Literaturquellen
[Bearbeiten | Quelltext bearbeiten]- Jan Faix: Formine und Aktinzytoskelett. In: BIOspektrum. Springer, Januar 2006 (biospektrum.de [PDF; abgerufen am 15. August 2015]).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ B. L. Goode und M. J. Eck: Mechanism and function of formins in the control of actin assembly. In: Annual Review of Biochemistry. 76. Jahrgang, 2007, S. 593–627, doi:10.1146/annurev.biochem.75.103004.142647, PMID 17373907.
- ↑ Jan Faix und R. Grosse: Staying in shape with formins. In: Developmental cell. 10. Jahrgang, Nr. 6, Juni 2006, S. 693–706, PMID 16740473.
- ↑ Chikako Kitayama und Taro Q. P. Uyeda: ForC, a novel type of formin family protein lacking an FH1 domain, is involved in multicellular development in Dictyostelium discoideum. In: Journal of Cell Science. 116 (Pt. 4). Jahrgang, Februar 2003, S. 711–723, PMID 12538772.
- ↑ R. Takeya und H. Sumimoto: Fhos, a mammalian formin, directly binds to F-actin via a region N-terminal to the FH1 domain and forms a homotypic complex via the FH2 domain to promote actin fiber formation. In: Journal of Cell Science. 166 (Pt. 22). Jahrgang, November 2003, S. 4567–4575, doi:10.1242/jcs.00769, PMID 14576350.
- ↑ Y. Xu, J. B. Moseley, I. Sagot, F. Poy, D. Pellman, B. L. Goode und M. J. Eck: Crystal structures of a Formin Homology-2 domain reveal a tethered dimer architecture. In: Cell. 116. Jahrgang, Nr. 5, März 2004, S. 711–723, doi:10.1016/S0092-8674(04)00210-7, PMID 15006353.
- ↑ InterPro: IPR015425 Formin, FH2 domain (englisch)
- ↑ Dimitra Chalkia, Nikolas Nikolaidis, Wojciech Makalowski, Jan Klein und Masatoshi Nei: Origins and Evolution of the Formin Multigene Family That Is Involved in the Formation of Actin Filaments. In: Molecular Biology and Evolution. 25. Jahrgang, Nr. 12, Dezember 2008, S. 2717–2733, doi:10.1093/molbev/msn215, PMC 2721555 (freier Volltext).
- ↑ Richard P. Woychik, R. L. Maas, R. Zeller, T. F. Vogt und P. Leder: 'Formins': proteins deduced from the alternative transcripts of the limb deformity gene. In: Nature. 346. Jahrgang, Nr. 62787, August 1990, S. 850–853, doi:10.1038/346850a0, PMID 2392150.
- ↑ Formin 1. In: Online Mendelian Inheritance in Man. (englisch)