Lichen planus mucosae
| Klassifikation nach ICD-10 | |
|---|---|
| L43 | Lichen ruber planus (Exkl. Lichen pilaris) |
| ICD-10 online (WHO-Version 2019) | |
| Klassifikation nach ICD-11 | |
|---|---|
| 14 | Krankheiten der Haut → Entzündliche Dermatosen → papulosquamöse Dermatosen |
| EA91 | Lichen ruber planus |
| EA91.3 | Lichen ruber planus der Haut oder Schleimhaut der Genitalien |
| EA91.4 | Lichen ruber planus und lichenoide Reaktionen der Mundschleimhaut |
| ICD-11: Englisch • Deutsch (Entwurf) | |
Der Lichen planus mucosae bezeichnet die Schleimhautmanifestation des Lichen ruber planus (kurz: Lichen ruber oder Lichen planus, auch: Knötchenflechte). Im Rahmen einer generalisierten Erkrankung oder isoliert entstehen Läsionen zumeist an den Schleimhäuten der Mundhöhle oder des Genital- und Analbereiches, seltener auch der Augen, des Nasenrachenraumes, der Speiseröhre und der Harnwege. Dabei zeigt sich – wie auch bei der kutanen Variante der Erkrankung – eine große morphologische Vielfalt, am häufigsten finden sich jedoch weiße Papeln oder netzartige Streifen sowie Erosionen der Schleimhaut.
Die Diagnose kann in der Regel im Rahmen einer zahnärztlichen, gynäkologischen oder urologischen Untersuchung, ggf. auch mittels Entnahme einer Gewebeprobe gestellt werden, bei Beteiligung der Speiseröhre ist eine Spiegelung des oberen Verdauungstraktes erforderlich. Therapeutisch kommen üblicherweise Cortisonpräparate zum Einsatz. Da der Krankheitsverlauf häufig chronisch ist, dient die Behandlung im Wesentlichen der Symptomkontrolle und der Vermeidung von Spätfolgen. Hierzu wird auch die Entwicklung eines Plattenepithelkarzinoms (weißer Hautkrebs) gezählt.
Verbreitung
[Bearbeiten | Quelltext bearbeiten]Angaben zur Prävalenz des oralen Lichen planus schwanken zwischen 0,9 %[1] und 1,27 %[2] der Allgemeinbevölkerung. Läsionen der Mundschleimhaut treten in ca. 60 % der Fälle eines generalisierten Lichen planus auf, ein reiner Befall der Mundschleimhaut macht ca. 15–35 % der Fälle eines Oralen Lichen planus aus.[3] Anders als bei der kutanen Form des Lichen planus sind Frauen deutlich häufiger betroffen als Männer, typisches Erkrankungsalter ist das siebte Lebensjahrzehnt.
Anogenitale Läsionen treten im Rahmen eines klassischen Lichen planus in ca. 25 bis 40 %[4] der Fälle auf. Bei Frauen zeigt sich eine gleichzeitige Beteiligung von Haut und Vulva in ca. 50 % der Fälle.[5]
Schleimhautläsionen außerhalb von Mundraum und Genitalbereich sind selten.
Ursache
[Bearbeiten | Quelltext bearbeiten]Wie bei der kutanen Variante des Lichen planus ist die Ätiologie nicht vollständig geklärt. Der Erkrankung liegt ein Autoimmunprozess zugrunde, der durch verschiedene Faktoren angestoßen werden kann. Dazu gehören:
Genetik: Träger(innen) bestimmter, für die Steuerung der individuellen Immunantwort verantwortlicher Klasse II-HLA-Gene sind häufiger von der Krankheit betroffen als andere Menschen.
Allergische Reaktionen: für den oralen Lichen planus besteht ein Zusammenhang mit Zahnfüllungen, im Speziellen aus Amalgam.[6]
Infektionen: lokale bakterielle Infektionen der Mundschleimhaut[7] und systemische Infektionen mit Humanen Papillom- (HPV)[8] oder Hepatitis-C-Viren (HCV)[9] stellen Risikofaktoren für den oralen Lichen planus dar.
Medikamente: Lichen-planus-typische Läsionen der Mundschleimhaut können durch verschiedene Medikamente hervorgerufen werden.[10]
Krankheitsentstehung
[Bearbeiten | Quelltext bearbeiten]Die ursächlichen Faktoren lösen einen Autoimmunprozess aus, indem sie eine Veränderung der Oberflächenstruktur der Keratinozyten (Zellen der oberen Schleimhautschicht) oder die veränderte Präsentation von Antigenen durch antigenpräsentierende Zellen im Schleimhautepithel (obere Schleimhautschicht) bewirken. Keratinozyten und antigenpräsentierende Zellen schütten daraufhin Entzündungsmediatoren aus, die wiederum T-Lymphozyten, eine Untergruppe der weißen Blutkörperchen, dazu anregen, in die Lamina propria (dünne Bindegewebsschicht unter dem Epithel) einzuwandern. Die Lymphozyten setzen weitere Mediatoren frei, die zum Untergang von Keratinozyten in den unteren Zelllagen des Epithels führt.[11]
Klinisches Erscheinungsbild
[Bearbeiten | Quelltext bearbeiten]Oraler Lichen planus
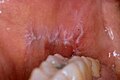
[Bearbeiten | Quelltext bearbeiten]Läsionen treten an den Lippen und an der Schleimhaut von Wangen, Mundvorhof, Zahnfleisch, Zunge sowie hartem und weichen Gaumen auf. Verschiedene klinische Präsentationen sind möglich: typischerweise zeigen sich netzartig-streifige, häufig als farnkrautartig beschriebene weißliche Schleimhautveränderungen (Wickham striae), eventuell mit mehr oder weniger papulösen oder plaqueartigen Anteilen (retikulopapulöse Form). Die Veränderungen treten symmetrisch und besonders häufig an der Wangenschleimhaut auf und sind meistens symptomlos.
Bei der erosiv-erythematösen Form führen ursprünglich vesikuläre oder bullöse (mit Blasen einhergehende) Läsionen nach ihrer Eröffnung zu Erosionen (oberflächlichen Schleimhautdefekten) der häufig stark geröteten Schleimhaut. Eine diffuse Manifestation dieser Form wird auch als desquamative Gingivitis bezeichnet. Die Erosionen können schmerzhaft sein.
Die ulzeröse Form des oralen Lichen planus geht mit fibrinös belegten Ulzerationen (tiefer reichenden Schleimhautdefekten) der Mundschleimhaut einher, die auf Berührung, Alkohol oder scharf gewürzte Speisen schmerzhaft sind.
-
Lichen planus der Wangenschleimhaut
-
Wickham striae
-
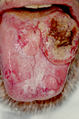
Lichen planus der Zunge, rechts oben im Bild mit Plattenepithelkarzinom
Anogenitaler Lichen planus
[Bearbeiten | Quelltext bearbeiten]Häufigste Manifestationsform in dieser Lokalisation ist der erosive Lichen planus, aber auch papulöse, annuläre oder bullöse Läsionen kommen vor.
Bei Frauen zeigen sich an der Vulva-, Vaginal- und Cervixschleimhaut Erosionen, die gegebenenfalls von netzartigen weißen Streifen umgeben werden. Vulväre Läsionen können mit starkem Juckreiz einhergehen, aber auch brennende Schmerzen und – bei vaginaler Lokalisation – postkoitale (nach dem Geschlechtsverkehr auftretenden) Blutungen können auftreten. Bei Abheilung der Läsionen mit Vernarbung können vulväre Verwachsungen und eine Vaginalstenose (Verengung der Vagina) resultieren.
Bei Männern entwickeln sich Läsionen oft an der Eichel, bei Beteiligung der Vorhaut eventuell mit Phimose (Vorhautverengung).
An der Schleimhaut des Analbereiches finden sich häufiger warzenartige hypertrophische Läsionen, die bei Ulzeration zu schmerzhaften Fissuren, eventuell mit sekundären Infektionen führen können.
Das gleichzeitige Auftreten eines erosiven genitalen Lichen planus mit oralen Manifestationen an der Gingivalschleimhaut (Schleimhaut des Zahnfleischs) wird als Vulvovaginal-gingivales Syndrom bezeichnet. Es handelt sich um ein ungewöhnliches Bild, das noch seltener als penogingivales Syndrom bei Männern auftritt.[12]
Extrakutaner Lichen planus
[Bearbeiten | Quelltext bearbeiten]Insgesamt selten, aber unter den Manifestationen im Verdauungstrakt am häufigsten ist der Lichen planus mucosae der Speiseröhre, der meist bei Frauen mittleren oder höheren Alters[13] und in der Regel zusammen mit oralen Läsionen auftritt. Er geht meist mit chronischen Schmerzen einher und kann zu Vernarbung mit resultierenden Strikturen und Stenosen (Verengungen) der Speiseröhre führen.
Noch seltener treten Läsionen an den Augen auf. Hier können sie sich als (Kerato-)Konjunktivitis, Ulzeration der Kornea (Hornhaut des Auges), Iridozyclitis, Chorioretinitis, Blepharitis oder Läsionen der Augenlider manifestieren. In der Regel bestehen okuläre Läsionen in Verbindung mit Haut- und/oder weiteren Schleimhaut-Manifestationen.
Diagnose
[Bearbeiten | Quelltext bearbeiten]Die Diagnostik umfasst neben der Anamnese (Erhebung der Krankengeschichte) eine klinische Untersuchung, wobei im Falle einer primär dermatologischen Untersuchung auch Manifestationen in der Mundhöhle und im Genitalbereich erfragt und inspiziert werden sollten. Eine gezieltere Untersuchung von Mundhöhle und Urogenitaltrakt erfolgt im Rahmen einer zahnärztlichen oder gynäkologischen bzw. urologischen Untersuchung.
Lässt sich die Diagnose nicht klinisch sichern, kann eine Biopsie (Gewebeprobe) aus auffälliger Schleimhaut zur Untersuchung unter dem Mikroskop entnommen werden. Speziell im Falle erosiver oder ulzeröser Läsionen wird die Probenentnahme aus deren Randbereich empfohlen, um beurteilbare Anteile des Epithels zu erfassen und das Risiko einer ulzerös-entzündlichen Überlagerung der krankheitsspezifischen histomorphologischen Merkmale des Lichen planus mucosae zu minimieren. Auch im Falle dauerhaft und insbesondere unter Therapie weiterbestehender Läsionen sollte eine bioptische Untersuchung erfolgen. Wird eine zweite Gewebeprobe aus läsionaler Schleimhaut entnommen und unfixiert ins Labor geschickt, kann diese mittels direkter Immunfluoreszenz untersucht werden. Die Untersuchungsmethode kommt in der Standarddiagnostik nicht zum Einsatz, kann aber im Falle vesikobullöser Läsionen die Differentialdiagnose zu anderen blasenbildenden Schleimhauterkrankungen erleichtern.
Bei entsprechendem klinischen Verdacht, z. B. aufgrund von Schluckbeschwerden, sollte eine endoskopische Untersuchung zur Frage einer Beteiligung der Speiseröhre erfolgen. Bei Patienten aus Regionen mit hoher HCV-Prävalenz kann außerdem ein HCV-Test durchgeführt werden.[14]
Pathologie
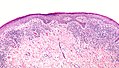
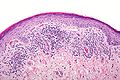
[Bearbeiten | Quelltext bearbeiten]Die retikulopapulöse Form des oralen Lichen planus geht zumeist mit Orthohyperkeratose oder mit Parakeratose (überschießender Verhornung) sowie mit variabler, eventuell sägezahnartiger Akanthose (Verbreiterung des Stratum spinosum) und Hypergranulose (Verbreiterung des Stratum granulosum) des Epithels einher. Im Gegensatz dazu zeigt sich bei der erosiv-erythematösen Form ein nicht verhornendes oder atrophes (verschmälertes) Epithel, gegebenenfalls mit Erosionen. Auch genitale Schleimhautläsionen können sowohl Akanthose als auch Atrophie aufweisen. In beiden Lokalisationen besteht eine variable Spongiose (intraepitheliales Ödem). In der Basalzellschicht (unteren Zelllage des Epithels) sowie in der unmittelbar subepithelialen Lamina propria finden sich zugrundegegangene Keratinozyten (engl.: Civatte bodies), die allerdings in genitalen Läsionen seltener sind.
Als Folge des Zelluntergangs können im Schnittpräparat entlang der Grenze zwischen Epithel und Lamina propria Spalträume entstehen, die zumeist aufarbeitungsbedingt entstanden und von echten Blasen abzugrenzen sind.[15] Die erhaltenen basalen Keratinozyten weisen gelegentlich entzündlich bedingte Atypien auf. Insbesondere in oralen Läsionen kann die Basalmembran (Grenzschicht zwischen Epithel und unterliegender Lamina propria) durch Ablagerung von Fibrinogen verdickt erscheinen.
In der Lamina propria zeigt sich ein bandartiges Infiltrat aus Lymphozyten, das auch auf das Epithel übergreift.[16] Im Falle gingivaler oder genitaler Läsionen enthält das Infiltrat neben Lymphozyten in der Regel Plasmazellen, die auch bei erosiven und bei allergisch bedingten Läsionen der Mundschleimhaut häufiger vorkommen. In länger bestehenden genitalen Läsionen zeigt sich eventuell nur noch ein herdförmiges und schütteres Infiltrat.[17][18]
-
Lichen planus mit Hypergranulose und bandförmigem Infiltrat aus Lymphozyten (niedrige Vergrößerung)
-
Lichen planus mit Hypergranulose und bandförmigem Infiltrat aus Lymphozyten (mittlere Vergrößerung)
Komplikationen
[Bearbeiten | Quelltext bearbeiten]Mit Vernarbung einhergehende Abheilung der Läsionen kann zu Verwachsungen und Stenosen in den betroffenen Lokalisationen führen.
Als weitere Komplikation wird die Entwicklung eines Plattenepithelkarzinoms (weißer Hautkrebs) der Mund-[19] bzw. Speiseröhrenschleimhaut[20] oder des Anogenitalbereiches[21][22][23] diskutiert.
Behandlung
[Bearbeiten | Quelltext bearbeiten]Da der Krankheitsverlauf häufig chronisch ist, dient die Therapie im Wesentlichen der Symptomkontrolle und der Reduktion von Komplikationen.
Oraler Lichen planus
[Bearbeiten | Quelltext bearbeiten]Als First line-Therapie werden topische Cortisonpräparate als Paste, Lutschtabletten, Lösung, Pellett oder Spray empfohlen. Insbesondere bei ulzerösen Läsionen können lokale Cortisoninjektionen erwogen werden, die allerdings schmerzhaft sind. Eine weitere Option sind topische Retinoide. Die empfohlenen Möglichkeiten einer systemischen Therapie umfassen oral verabreichte Cortisonpräparate, alternativ Retinoide oder Ciclosporin.
Als Second line-Therapie werden Calcineurin-Inhibotoren (Tacrolimus und Pimecrolimus, topisch), Sulfasalazin, Azathioprin, Hydroxychloroquin, Methotrexat, Mycophenolat-Mofetil und TNF-α-Inhibitoren vorgeschlagen.
In der Third line-Therapie können Cyclophosphamid, Thalidomid, Antibiotika, Itraconazol, Griseofulvin, Dapson, niedermolekulares Heparin, Interferon (bei gleichzeitiger Hepatitis C), PUV-A und eine YAG-Laser-Behandlung versucht werden.
Unterstützende Maßnahmen bestehen im Ersatz von Zahnfüllungen aus Amalgam und Gold durch andere Materialien, professionelle Zahnreinigung, guter Mundhygiene, Verzicht auf Nikotin, Meiden von Mundschleimhautverletzungen, scharf gewürzten Speisen, Alkohol sowie von Stress und Aufregung. Gegebenenfalls kann psychische Unterstützung eine sinnvolle Ergänzung zur symptomatischen Therapie sein.[14]
Genitaler Lichen planus
[Bearbeiten | Quelltext bearbeiten]Ziel der Behandlung ist im Wesentlichen die Reduktion bzw. Verhinderung funktionseinschränkender Vernarbung der Läsionen.
Die papulosquamöse Form des Lichen planus verläuft meist selbstlimitierend, sodass eine lokale Behandlung mit Cortison und Pflegecreme für einige Wochen in der Regel ausreichend ist.
Im Übrigen besteht die empfohlene First line-Therapie in der Applikation topischer Cortisonpräparate z. B. als Zäpfchen. Diese werden zunächst hochdosiert, in der anschließenden Erhaltungstherapie in niedrigerer Dosierung oder Applikationsfrequenz eingesetzt. Alternativ ist der Einsatz niedrig dosierter trizyklischer Antidepressiva möglich.
Als Second line-Therapie werden Calcineurin-Inhibitoren (Tacrolimus oder Pimecrilimus), lokalanästhetisches Gel oder Antihistaminika vorgeschlagen.[14]
Wegen des erhöhten Risikos eines genitalen Plattenepithelkarzinoms sollten Kontrolluntersuchungen und eine Sensibilisierung der Patienten für die entsprechenden Symptome erfolgen.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Konrad Bork, Walter Burgdorf, Nikolaus Hoede: Mundschleimhaut- und Lippenkrankheiten: Klinik, Diagnostik und Therapie. Atlas und Handbuch. Schattauer, 2008, ISBN 978-3-7945-2486-0, Kapitel 22: Lichen ruber planus, S. 74–83, google.book
- SK. Edwards: European guideline for the management of balanoposthitis. In: Int JSTD AIDS, 2001, 12(Suppl. 3), S. 68–72.
- Rajani Katta: Diagnosis and Treatment of Lichen Planus. In: Am Fam Physician., 1. Juni 2000, 61(11), S. 3319–3324, aafp.org
- G Kirtschig, SH Wakelin, F. Wojnarowska: Mucosal vulval lichen planus: outcome, clinical and laboratory features. In: Journal of the European Academy of Dermatology and Venereology, 2005, 19(3), S. 301–307.
- Laurence Le Cleach, Olivier Chosidow: Clinical practice: Lichen Planus. In: New England Journal of Medicine, 366:8, 23. Februar 2012, S. 723–732.
- G. Wagner, C. Rose, M. M. Sachse: Clinical variants of lichen planus. In: Journal der Deutschen Dermatologischen Gesellschaft, 2013, doi:10.1111/ddg.12031
- Alberto Rosenblatt, Homero Gustavo Campos Guidi, Walter Belda: Male Genital Lesions: The Urological Perspective. Springer-Verlag, 2013, ISBN 3-642-29016-7 Google Books S. 93–95
- Hywel Williams, Michael Bigby, Thomas Diepgen, Andrew Herxheimer, Luigi Naldi, Berthold Rzany: Evidence-Based Dermatology. John Wiley & Sons, Kapitel 22: Lichen planus, S. 189 ff., 744 Seiten.
- S. Regauer: Vulväre und penile Karzinogenese: Transformierende HPV-High-risk-Infektionen und Dermatosen (Lichen sclerosus und Lichen planus). In: Journal für Urologie und Urogynäkologie, 2012, 19 (2), S. 22–25
- Libby Edwards, Peter J. Lynch: Genital Dermatology Atlas. Lippincott Williams and Wilkins, 2010, ISBN 978-1-60831-079-1, 384 S.
- Eduardo Calonje, Thomas Brenn, Alexander Lazar, Steven D. Billings: McKee's pathology of the skin with clinical correlations. Fifth edition Auflage. Band 1. Elsevier, ohne Ort 2020, ISBN 978-0-7020-7552-0, S. 241–251, 433–435, 483–85.
- D. Ioannides, E. Vakirlis et al.: EDF S1 Guidelines on the management of Lichen Planus. (PDF) In: European Dermatology Forum. Abgerufen am 14. März 2020 (englisch).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Hautlexikon: Lichen ruber planus (Knötchenflechte). In: Online Hautarzt-AppDoc. Abgerufen am 9. März 2020.
- Angela Unholzer: Lichen ruber planus (Knötchenflechte). In: www.apotheken-umschau.de. Wort & Bild Verlag, 10. Oktober 2018, abgerufen am 9. März 2020.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Changchang Li, Xiaoqiong Tang, Xiaoyan Zheng, Shuqi Ge, Hao Wen: Global Prevalence and Incidence Estimates of Oral Lichen Planus: A Systematic Review and Meta-analysis. In: JAMA Dermatology. 2. Januar 2020, ISSN 2168-6068, doi:10.1001/jamadermatol.2019.3797 (jamanetwork.com [abgerufen am 8. Februar 2020]).
- ↑ B. E. McCartan, C. M. Healy: The reported prevalence of oral lichen planus: a review and critique: Prevalence of oral lichen planus. In: Journal of Oral Pathology & Medicine. Band 37, Nr. 8, 9. Juli 2008, S. 447–453, doi:10.1111/j.1600-0714.2008.00662.x.
- ↑ Eduardo Calonje, Thomas Brenn, Alexander Lazar, Steven D. Billings: McKee's pathology of the skin with clinical correlations. Fifth edition Auflage. Band 1. Elsevier, ohne Ort 2020, ISBN 978-0-7020-7552-0, S. 241.
- ↑ Eduardo Calonje, Thomas Brenn, Alexander Lazar, Steven D. Billings: McKee's pathology of the skin with clinical correlations. Fifth edition Auflage. Band 1. Elsevier, ohne Ort 2020, ISBN 978-0-7020-7552-0, S. 483.
- ↑ F. M. Lewis, M. Shah, C. I. Harrington: Vulval involvement in lichen planus: a study of 37 women. In: The British Journal of Dermatology. Band 135, Nr. 1, Juli 1996, ISSN 0007-0963, S. 89–91, PMID 8776366.
- ↑ P. Koch, F. A. Bahmer: Oral lesions and symptoms related to metals used in dental restorations: a clinical, allergological, and histologic study. In: Journal of the American Academy of Dermatology. Band 41, 3 Pt 1, September 1999, ISSN 0190-9622, S. 422–430, doi:10.1016/s0190-9622(99)70116-7, PMID 10459117.
- ↑ Yun Sik Choi, Yunji Kim, Hye-Jung Yoon, Keum Jin Baek, Jehan Alam: The presence of bacteria within tissue provides insights into the pathogenesis of oral lichen planus. In: Scientific Reports. Band 6, Nr. 1, Juli 2016, ISSN 2045-2322, doi:10.1038/srep29186, PMID 27383402, PMC 4935860 (freier Volltext).
- ↑ Junxian Ma, Jinshan Zhang, Yan Zhang, Tingting Lv, Jie Liu: The Magnitude of the Association between Human Papillomavirus and Oral Lichen Planus: A Meta-Analysis. In: PLOS ONE. Band 11, Nr. 8, 29. August 2016, ISSN 1932-6203, doi:10.1371/journal.pone.0161339, PMID 27571417, PMC 5003373 (freier Volltext).
- ↑ Na Alaizari, Sa Al-Maweri, Hm Al-Shamiri, B Tarakji, B Shugaa-Addin: Hepatitis C virus infections in oral lichen planus: a systematic review and meta-analysis. In: Australian Dental Journal. Band 61, Nr. 3, September 2016, S. 282–287, doi:10.1111/adj.12382.
- ↑ C. Scully, M. Beyli, M. C. Ferreiro, G. Ficarra, Y. Gill: Update on oral lichen planus: etiopathogenesis and management. In: Critical Reviews in Oral Biology and Medicine: An Official Publication of the American Association of Oral Biologists. Band 9, Nr. 1, 1998, ISSN 1045-4411, S. 86–122, doi:10.1177/10454411980090010501, PMID 9488249.
- ↑ L. R. Eversole: Immunopathogenesis of oral lichen planus and recurrent aphthous stomatitis. In: Seminars in Cutaneous Medicine and Surgery. Band 16, Nr. 4, Dezember 1997, ISSN 1085-5629, S. 284–294, doi:10.1016/s1085-5629(97)80018-1, PMID 9421220.
- ↑ Eduardo Calonje, Thomas Brenn, Alexander Lazar, Steven D. Billings: McKee's pathology of the skin with clinical correlations. Fifth edition Auflage. Band 1. Elsevier, ohne Ort 2020, ISBN 978-0-7020-7552-0, S. 483 f.
- ↑ Vishal S. Chandan, Joseph A. Murray, Susan C. Abraham: Esophageal lichen planus. In: Archives of Pathology & Laboratory Medicine. Band 132, Nr. 6, Juni 2008, ISSN 1543-2165, S. 1026–1029, PMID 18517264.doi:10.1043/1543-2165(2008)132[1026:ELP]2.0.CO;2 (zurzeit nicht erreichbar)
- ↑ a b c D. Ioannides, E. Vakirlis et al.: EDF S1 Guidelines on the management of Lichen Planus. (PDF) In: European Dermatology Forum. Abgerufen am 14. März 2020 (englisch).
- ↑ Yi-Shing Lisa Cheng, Alan Gould, Zoya Kurago, John Fantasia, Susan Muller: Diagnosis of oral lichen planus: a position paper of the American Academy of Oral and Maxillofacial Pathology. In: Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology. Band 122, Nr. 3, September 2016, ISSN 2212-4411, S. 332–354, doi:10.1016/j.oooo.2016.05.004, PMID 27401683.
- ↑ L. R. Eversole: Immunopathogenesis of oral lichen planus and recurrent aphthous stomatitis. In: Seminars in Cutaneous Medicine and Surgery. Band 16, Nr. 4, Dezember 1997, ISSN 1085-5629, S. 284–294, doi:10.1016/s1085-5629(97)80018-1, PMID 9421220.
- ↑ Eduardo Calonje, Thomas Brenn, Alexander Lazar, Steven D. Billings: McKee's pathology of the skin with clinical correlations. Fifth edition Auflage. Ohne Ort, ISBN 978-0-7020-7552-0, S. 434.
- ↑ Eduardo Calonje, Thomas Brenn, Alexander Lazar, Steven D. Billings: McKee's pathology of the skin with clinical correlations. Fifth edition Auflage. Ohne Ort, ISBN 978-0-7020-7552-0, S. 485.
- ↑ Majdy Idrees, Omar Kujan, Kate Shearston, Camile S. Farah: Oral lichen planus has a very low malignant transformation rate: A systematic review and meta-analysis using strict diagnostic and inclusion criteria. In: Journal of Oral Pathology & Medicine: Official Publication of the International Association of Oral Pathologists and the American Academy of Oral Pathology. 25. Januar 2020, ISSN 1600-0714, doi:10.1111/jop.12996, PMID 31981238.
- ↑ Karthik Ravi, D. Chamil Codipilly, Dharma Sunjaya, Hongfei Fang, Amindra S. Arora: Esophageal Lichen Planus Is Associated With a Significant Increase in Risk of Squamous Cell Carcinoma. In: Clinical Gastroenterology and Hepatology: The Official Clinical Practice Journal of the American Gastroenterological Association. Band 17, Nr. 9, August 2019, ISSN 1542-7714, S. 1902–1903.e1, doi:10.1016/j.cgh.2018.10.018, PMID 30342260.
- ↑ F. M. Lewis, C. I. Harrington: Squamous cell carcinoma arising in vulval lichen planus. In: The British Journal of Dermatology. Band 131, Nr. 5, November 1994, ISSN 0007-0963, S. 703–705, doi:10.1111/j.1365-2133.1994.tb04987.x, PMID 7999604.
- ↑ S. Fundarò, A. Spallanzani, E. Ricchi, A. Carriero, S. Perrone: Squamous-cell carcinoma developing within anal lichen planus: report of a case. In: Diseases of the Colon and Rectum. Band 41, Nr. 1, Januar 1998, ISSN 0012-3706, S. 111–114, doi:10.1007/bf02236905, PMID 9510320.
- ↑ S. Leal-Khouri, G. J. Hruza: Squamous cell carcinoma developing within lichen planus of the penis. Treatment with Mohs micrographic surgery. In: The Journal of Dermatologic Surgery and Oncology. Band 20, Nr. 4, April 1994, ISSN 0148-0812, S. 272–276, doi:10.1111/j.1524-4725.1994.tb01624.x, PMID 8163749.