Neophylchlorid
Zur Navigation springen
Zur Suche springen
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Neophylchlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H13Cl | ||||||||||||||||||
| Kurzbeschreibung |
hellgelbe Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 168,66 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,047 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
sehr gut löslich in Aceton, Benzol, Diethylether und Ethanol[2] | ||||||||||||||||||
| Brechungsindex |
1,524 (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Neophylchlorid ist eine chemische Verbindung aus der Gruppe der Chlorkohlenwasserstoffe.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Neophylchlorid (siehe unten Abb. 2) kann durch Alkylierung von Benzol mit 3-Chlor-2-methylpropen (1) in Gegenwart von Schwefelsäure gewonnen werden.[3][4]
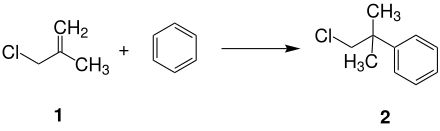
Neophylchlorid kann auch durch Chlorierung von tert-Butylbenzol (zum Beispiel mit Sulfurylchlorid) dargestellt werden.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Neophylchlorid ist eine hellgelbe Flüssigkeit,[1] die sehr gut löslich in Aceton, Benzol, Diethylether und Ethanol ist.[2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Neophylchlorid wird als Zwischenprodukt für organische Synthesen (zum Beispiel Fenbutatinoxid[6]) verwendet.[7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Datenblatt 2-Chloromethyl-2-phenylpropane, 99% bei Sigma-Aldrich, abgerufen am 9. Januar 2019 (PDF).
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics. CRC Press, 2016, ISBN 978-1-4987-5429-3, S. 104 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Harry H. Szmant, Szmant: Organic Building Blocks of the Chemical Industry. John Wiley & Sons, 1989, ISBN 0-471-85545-6, S. 346 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ W. T. Smith, Jr. und J. T. Sellas: Neophyl chloride In: Organic Syntheses. 32, 1952, S. 90, doi:10.15227/orgsyn.032.0090; Coll. Vol. 4, 1963, S. 702 (PDF).
- ↑ William E. Truce, E. T. McBee, C. C. Alfieri: Chlorination of t-Butylbenzene to 1-Chloro-2-methyl-2-phenylpropane. In: Journal of the American Chemical Society. 71, 1949, S. 752, doi:10.1021/ja01170a520.
- ↑ Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, 1996, ISBN 978-0-8155-1853-2, S. 400 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Frank C. Whitmore, Cyrus A. Weisgerber, A. C. Shabica: Formation of Cyclopropanes from Monohalides. IV. Some Reactions of 1-Chloro-2-methyl-2-phenylpropane (Neophyl Chloride). In: Journal of the American Chemical Society. 65, 1943, S. 1469, doi:10.1021/ja01248a010.