Parabansäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
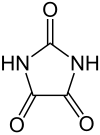
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Parabansäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H2N2O3 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 114,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Alkohol und Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Parabansäure ist eine chemische Verbindung aus der Gruppe der Ureide.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Parabansäure kann durch Reaktion von Harnstoff mit Diethyloxalat und anschließender Reaktion des daraus gewonnenen Zwischenproduktes mit Salzsäure gewonnen werden.[3] Ebenfalls möglich ist die Synthese durch Reaktion von Harnstoff und Oxalylchlorid oder neben Alloxan durch Oxidation von Harnsäure mit 30%igem Wasserstoffperoxid.[1]
Die Verbindung wurde erstmals 1838 durch Justus von Liebig und Friedrich Wöhler durch Einwirkung von Salpetersäure auf Harnsäure hergestellt.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Parabansäure ist ein farbloser kristalliner Feststoff, der löslich in Alkohol und Wasser ist.[1] Sie ist eine zweibasische Säure, aber bildet fast nur saure instabile Salze.[4] Die Reduktion von Parabansäure führt zu Hydantoin (Imidazolidindion), das als aktive Methylen-Komponente in Kondensationsreaktionen eingesetzt wird (analog Erlenmeyer-Synthese).[1] Er besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2) und den Gitterparametern a = 10,684, b = 8,194, c = 5,044 Å, β = 92°30′ und vier Molekülen pro Zelle.[5]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Parabansäure wird als Zwischenprodukt zur Herstellung anderer chemischer Verbindungen (wie Pyridine) verwendet.[2] Es kann auch als (Co-)Monomer in Polymerisationen genutzt werden.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Eintrag zu Parabansäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. April 2021.
- ↑ a b c d e Datenblatt Parabansäure, 99% bei Sigma-Aldrich, abgerufen am 5. April 2021 (PDF).
- ↑ unbekannt: PARABANIC ACID. In: Organic Syntheses. 37, 1957, S. 71, doi:10.15227/orgsyn.037.0071.
- ↑ a b Ladenburg: Encyklopaedie der Naturwissenschaften. E. Trewendt, 1887, S. 40 (books.google.com).
- ↑ David R. Davies, J. J. Blum: Crystal Structure of Parabanic Acid. In: Nature. Band 173, Nr. 4412, 1954, S. 993–993, doi:10.1038/173993a0 (nature.com).
