Plastocyanin
| Plastocyanin (Spinacia oleracea) | ||
|---|---|---|
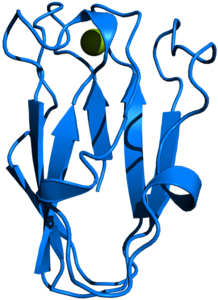
| ||
| Bändermodell des Plastocyanin aus dem Spinat, nach PDB 1AG6 | ||
|
Vorhandene Strukturdaten: 1B3I, 1BAW, 2Q5B, 3BQV, 3PCY, 4PCY, 5PCY, 6PCY, 7PCY, 9PCY | ||
| Masse/Länge Primärstruktur | 99 Aminosäuren, 10,4 kDa (Spinat) | |
| Kofaktor | Kupferion | |
| Isoformen | PET1, PET2 in A. thaliana | |
| Bezeichner | ||
| Gen-Name(n) | PETE | |
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Pflanzen, Cyanobakterien | |

Plastocyanin, manchmal auch als Plastocyan[2] bezeichnet, ist ein kleines Kupferprotein in Algen, grünen Pflanzen und einigen Cyanobakterien, das eine wichtige Rolle bei der Photosynthese spielt. Es transportiert Elektronen von dem Cytochrom-b6f-Komplex zum Photosystem I. In Eukaryoten ist Plastocyanin im Lumen der Thylakoide lokalisiert.[3]
Plastocyanin gehört zu den blauen Kupferproteinen, die in Pflanzen, Archaeen und Bakterien vorkommen.[4][5]
Struktur
[Bearbeiten | Quelltext bearbeiten]Plastocyanin ist in Spinat und den meisten anderen Organismen in seiner reifen Form 10,5 kDa schwer, sowie aus 99 Aminosäuren aufgebaut. Es bindet als Kofaktor koordinativ ein Kupferatom, welches durch Elektronenaufnahme zwischen den Oxidationsstufen CuII und CuI wechselt.[1] Das Protein kann also nur ein Elektron aufnehmen und wieder abgeben. Die Tertiärstruktur des Proteins ist ein β-barrel.
Funktion
[Bearbeiten | Quelltext bearbeiten]Die Lichtreaktion der Photosynthese ist eine Abfolge von Elektronenübergängen, die bei Pflanzen in den Thylakoiden der Chloroplasten stattfindet. Der Proteinkomplex Photosystem II gewinnt unter der Nutzung von Lichtenergie Elektronen aus Wasser. Die Elektronen werden zunächst auf das kleine Molekül Plastochinon, und dann über den Cytochrom-b6f-Komplex auf Plastocyanin und schließlich über das Photosystem I auf NADP+ übertragen. Plastocyanin ist ein löslicher Elektronenträger, der im Lumen des Thylakoiden diffundiert.
Das Elektron wird von Cytochrom-f, eine Untereinheit des Cytochrom-b6f-Komplexes, direkt auf Plastocyanin übertragen.[6] In einigen Cyanobakterien und Algen wird Plastocyanin durch das kleine, eisenhaltige Protein Cytochrom-c6 ersetzt. Plastocyanin und Cytochrom-c6 interagieren direkt mit Photosystem I und reduzieren dessen photooxidiertes Reaktionszentrum P700+.[7][8]
Expression und Topogenese
[Bearbeiten | Quelltext bearbeiten]Plastocyanin wird bei Pflanzen und Grünalgen im Kern von dem Gen petE kodiert, dessen cytosolisch translatiertes Produkt ein Präpro-Apoprotein mit N-terminalem Transitpeptid ist, welches nach dem Import in den Chloroplasten durch eine Peptidase abgespalten wird.[9] Diese Zwischenform wird dann über den SecA-Transportweg in das Thylakoidlumen befördert, wo es das Kupferatom bindet.[10]
Regulation der petE-Expression
[Bearbeiten | Quelltext bearbeiten]Die petE-Genexpression wird teils durch den zellulären Zuckerstatus reguliert (sugar sensing), so wird die Expression bei Akkumulation von Zuckern gehemmt.[11][12] Des Weiteren reprimiert auch eine Reduktion des Plastochinon-Pools und des Thioredoxin-Systems, sowie die Qualität des eingestrahlten Lichts (bzw. ein Wechsel von präferentiell Photosystem-II-anregendem Licht zu Photosystem-I-anregendem Licht) die petE-Expression.[13][14]
Daneben wird die petE-Expression durch die Anwesenheit reaktiver Sauerstoffspezies unterdrückt.[15] Dafür sind retrograde Signalwege erforderlich, die die Genexpression kernkodierter Gene in Abhängigkeit von plastidären Signalen regulieren.[16][17] Bei den erwähnten Untersuchungen wurde allerdings nur die petE-Genexpression und nicht die Akkumulation des Proteins analysiert, die nicht zwangsläufig übereinstimmen müssen.
Interaktion mit den Photosynthesekomplexen
[Bearbeiten | Quelltext bearbeiten]Plastocyanin bildet mit Cytochrom-f einen festen Übergangskomplex, wodurch eine sehr schnelle Elektronenübergabe innerhalb von 35 bis 350 µs ermöglicht wird.[18]
Arginine und Lysine in der Region zwischen der großen und kleinen Domäne von Cytochrom-f binden Plastocyanin möglicherweise über elektrostatische Kräfte.[18][19] Das reduzierte Plastocyanin interagiert in höheren Pflanzen direkt mit Photosystem I und bildet mit ihm einen Übergangskomplex. Daraufhin durchläuft der Komplex eine Konformationsänderung und ein Elektron wird an P700+ weitergegeben.[20] Die Elektronenübergabe von Plastocyanin an P700 ist mit einer Dauer von 10 bis 20 µs schnell[18], da reduziertes Plastocyanin stärker gebunden wird als oxidiertes Plastocyanin.[21] In den Kristallstrukturen von Photosystem I[7] ist eine flache Region auf der Lumenseite des Photosystems zu erkennen, die wahrscheinlich die Bindestelle für Plastocyanin ist. Luminale Schleifen von PsaA und PsaB tragen zur effizienten Bindung von Plastocyanin bei.[22][23] In Pflanzen wird des Weiteren durch zusätzliche Aminosäuren am N-Terminus von PsaF eine sehr viel festere Plastocyanin-Bindung erreicht, als in den meisten Cyanobakterien[8] – bei diesen interagiert Plastocyanin durch Kollision, und nicht spezifisch mit Photosystem I; die gemessenen Transfergeschwindigkeiten sind hier bis zu zwei Größenordnungen kleiner[24][20]. Allerdings formiert sich in Cyanobakterien ein fester Übergangskomplex zwischen Photosystem I und dem alternativen Elektronenträger Cytochrom-c6.[24]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Hans-Walter Heldt und Fiona Heldt (1999): Pflanzenbiochemie. Spektrum Akademischer Verlag, Heidelberg.
- K. Sigfridsson (1998): Plastocyanin, an electron-transfer protein. In: Photosynth Res 57(1) pp. 1–28; doi:10.1023/A:1006067631076
- G. S. Singhal, G. Renger und S. K. Sopory (1999): Concepts in Photobiology: Photosynthesis and Photomorphogenesis. Springer.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Y. Xue, M. Okvist, O. Hansson, S. Young: Crystal structure of spinach plastocyanin at 1.7 A resolution. In: Protein science : a publication of the Protein Society. Band 7, Nummer 10, Oktober 1998, S. 2099–2105, doi:10.1002/pro.5560071006, PMID 9792096, PMC 2143848 (freier Volltext).
- ↑ Peter Schopfer und Axel Brennicke: Pflanzenphysiologie. Elsevier, München 2006. ISBN 978-3-8274-1561-5, S. 189
- ↑ UniProt P00289
- ↑ Interpro: Plastocyanin
- ↑ PROSITE documentation PDOC00174. Type 1 (blue) copper proteins. Swiss Institute of Bioinformatics (SIB), abgerufen am 12. August 2011 (englisch).
- ↑ Sato K., Kohzuma T., Dennison C. (2003): Active-site structure and electron-transfer reactivity of plastocyanins. In: JACS vol. 125 (8) pp. 2101-2112; PMID 12590538
- ↑ a b Jordan P., Fromme P., Witt H.T., Klukas O., Saenger W., Krauß N. (2001): Three-dimensional structure of cyanobacterial photosystem I at 2.5Å resolution. In: Nature 411 (6840) pp. 909-917; PMID 11418848
- ↑ a b Ben-Shem A., Frolow F., Nelson N. (2003): Crystal structure of plant photosystem I. Nature 426 (6967) pp. 630-635; PMID 14668855
- ↑ Rother C., Jansen T., Tyagi A., Tittgen J., Herrmann R.G. (1986): Plastocyanin is encoded by an uninterrupted nuclear gene in spinach. In: Curr Genet 11 (3) pp. 171-176; PMID 2834087
- ↑ Li H.H., Quinn J., Culler D., Girard-Bascou J., Merchant S. (1996): Molecular genetic analysis of plastocyanin biosynthesis in Chlamydomonas reinhardtii. In: J Biol Chem 271 (49) pp. 31283-9
- ↑ Dijkwel P.P., Kock P., Bezemer R., Weisbeek P.J., Smeekens S.C. (1996): Sucrose Represses the Developmentally Controlled Transient Activation of the Plastocyanin Gene in Arabidopsis thaliana Seedlings. In: Plant Physiol 110 (2) pp. 455-463; PMID 12226197
- ↑ Oswald O., Martin T., Dominy P.J., Graham I.A. (2001): Plastid redox state and sugars: interactive regulators of nuclear-encoded photosynthetic gene expression. In: Proc Natl Acad Sci U S A 98 (4) pp. 2047-2052; PMID 11172073
- ↑ Pfannschmidt T., Schütze K., Brost M., Oelmüller R. (2001): A novel mechanism of nuclear photosynthesis gene regulation by redox signals from the chloroplast during photosystem stoichiometry adjustment. In: J Biol Chem 276 (39) pp. 36125-36130; PMID 11468291
- ↑ Schütze K., Steiner S., Pfannschmidt T. (2008): Photosynthetic redox regulation of the plastocyanin promoter in tobacco. In: Physiol Plant 133 (3) pp. 557-565; PMID 18419738
- ↑ Foyer C.H. und Noctor G. (2003): Redox sensing and signalling associated with reactive oxygen in chloroplasts, peroxisomes and mitochondria. In: Physiol Plant 119 (3) pp. 355-364
- ↑ Triantaphylidès C., Havaux M. (2009): Singlet oxygen in plants: production, detoxification and signaling. In: Trends Plant Sci 14 (4) pp. 219-228; PMID 19303348
- ↑ Foyer C.H., Noctor G., Buchanan B.B., Dietz K.J., Pfannschmidt T. (2009): Redox Regulation in Photosynthetic Organisms: Signaling, Acclimation, and Practical Implications. In: Antioxid Redox Signal 11 (4) pp. 861-905; PMID 19239350
- ↑ a b c Hope A.B. (2000): Electron transfers amongst cytochrome f, plastocyanin and photosystem I: kinetics and mechanisms. In: Biochim Biophys Acta 1456 (1) pp. 5-26; PMID 10611452
- ↑ Soriano G.M., Ponamarev M.V., Piskorowski R.A., Cramer W.A. (1998): Identification of the basic residues of cytochrome f responsible for electrostatic docking interactions with plastocyanin in vitro: relevance to the electron transfer reaction in vivo. In: Biochemistry 37 (43) pp. 15120-15128; PMID 9790675
- ↑ a b Hervás M., Navarro J.A., Molina-Heredia F.P., De La Rosa M.A. (1998): The reaction mechanism of Photosystem I reduction by plastocyanin and cytochrome c 6 follows two different kinetic models in the cyanobacterium Pseudanabaena sp. PCC 6903. In: Photosynth Res 57 (1) pp. 93-100
- ↑ Drepper F., Hippler M., Nitschke W., Haehnel W. (1996): Binding dynamics and electron transfer between plastocyanin and photosystem I. In: Biochemistry 35 (4) pp. 1282-1295; PMID 8573585
- ↑ Sommer F., Drepper F., Hippler M. (2002): The Luminal Helix l of PsaB Is Essential for Recognition of Plastocyanin or Cytochrome c6 and Fast Electron Transfer to Photosystem I in Chlamydomonas reinhardtii. In: J Biol Chem 277 (8) pp. 6573-6581; PMID 11744732
- ↑ Sommer F., Drepper F., Haehnel W., Hippler M. (2004): The Hydrophobic Recognition Site Formed by Residues PsaA-Trp651 and PsaB-Trp627 of Photosystem I in Chlamydomonas reinhardtii Confers Distinct Selectivity for Binding of Plastocyanin and Cytochrome c6. In: J Biol Chem 279 (19) pp. 20009-20017; PMID 14996834
- ↑ a b Fromme P. (2003): Structure and function of photosystem I: interaction with its soluble electron carriers and external antenna systems. In: FEBS Lett 555 (1) pp. 40-44; PMID 14630316