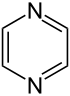
Pyrazin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Pyrazin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H4N2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle oder wachsartige Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 80,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,03 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
115–116 °C[2] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser, Ethanol und Diethylether[1] | ||||||||||||||||||
| Brechungsindex |
1,4953 (61 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
139,8 kJ/mol[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Pyrazin (1,4-Diazin) ist eine chemische Verbindung und Namensgeber für die Stoffgruppe der Pyrazine. Es handelt sich um ein Heteroaromat, genauer ein Diazin bzw. Diazabenzol.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Über die Synthese von Pyrazin wurde erstmals 1844 von Auguste Laurent berichtet, wobei 1897 von L. H. Snape und A. Brooke bestätigt wurde, dass es sich um 2,3,5,6-Tetraphenylpyrazin[6] handelt. Laurent nannte diese Verbindung „Amarone“.[7][8]
Ab diesem Zeitpunkt wurden verschiedene Derivate von Pyrazin hergestellt. 1882 war Severin Segelcke Wleügel jedoch der erste, der vorschlug, dass Pyrazin aus einem sechsgliedrigen Ring analog zu Pyridin besteht. Im Jahre 1887 schlugen Arthur T. Mason und Ludwig Wolff getrennt voneinander vor, dass das Wort „Pyrazin“ für die oben erwähnte Verbindung verwendet werden kann. Sie stellten klar, dass eine sechsgliedrige Ringverbindung, die aus vier Kohlenstoff- und zwei Stickstoffatomen besteht, als Diazin klassifiziert wird.[7] Das Stammverbindung Pyrazin wurde 1888 von Ludwig Wolff in Spuren durch Erhitzen von Aminoacetaldehyddiethylacetal mit Oxalsäure hergestellt.[9][8] Während dieser Zeit debattierten die Chemiker über die mögliche Bindungsstruktur des Pyrazins. So war entweder eine Anordnung vom Kekulé-Typ oder vom Dewar-Typ in Diskussion. Der Kekulé-Typ bezieht sich auf die konjugierte Doppelbindung innerhalb des Pyrazinmoleküls, während der Dewar-Typ sich auf die lange Parabindung bezieht, die die beiden Stickstoffatome bindet. Nach der Analyse der Molekularrefraktion verschiedener Pyrazinderivate bestätigte Julius Wilhelm Brühl schließlich, dass das Pyrazin in Kekulé-Konfiguration existiert.[7][10]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Pyrazin kommt in gerösteten Erdnüssen und anderen erhitzten Lebensmitteln vor.[11]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Pyrazin lässt sich bequem aus der Oxidation von Dihydropyrazin herstellen, das als Kondensationsprodukt eines Glyoxal mit 1,2-Diaminoethan entsteht. Kupfer(II)-oxid und Manganoxid werden üblicherweise als Oxidationsmittel für Dihydropyrazin verwendet.[7]
Yozo Ohtsuka et al. berichtete 1979 über eine alternativen Weg zur Synthese durch Cyclisierung von 2,3-Bis(arylidenamino)-3-cyanoarylamiden zur Bildung des Pyrazin-Vorläufers 1,2-Dihydropyrazin.[7][12]
Ebenfalls möglich ist die Darstellung durch Reaktion von Diamin mit Diolen in Gegenwart eines Metallkatalysators (zum Beispiel durch Reaktion von Ethylendiamin mit Ethylenglycol bei 400 °C an Zinkoxid-Katalysatoren[1]) oder der Reaktion von Diamin mit Dicarbonylen.[7]
Auch die Synthese durch katalytische Dehydrogenierung von Monoethanolamin in Gegenwart von Kupfer, Kupfer- und Zinkoxid, Zinkoxid und Natriumcarbonat bei 250–300 °C oder durch Deaminocyclisierung von Ethylendiamin gefolgt von Dehydrierung über Kupferchromit oder durch Kondensation von Glyoxal und Ethylendiamin bei hohen Temperaturen mit einem Kupfer-Chromoxidkatalysator ist möglich.[13]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Pyrazin ist ein farbloser, leicht entzündlicher Feststoff, der löslich in Wasser, Ethanol und Diethylether ist.[1] Er besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Pmnn (Raumgruppen-Nr. 58, Stellung 3) und zwei Molekülen pro Elementarzelle.[14] Das Molekül ist planar.[8] Da Pyrazin eine aromatische Verbindung ist, kann es als ein Resonanzhybrid aus einer Reihe von kanonischen Strukturen dargestellt werden. Aufgrund der symmetrischen Natur des Moleküls ist das Dipolmoment von Pyrazin gleich Null.[13]
1957 bestimmte Peter Jaffrey Wheatley die Struktur von Pyrazin mit Hilfe der Röntgenstrukturanalyse, wobei die Länge der C-C-, C-N- und C-H-Bindung mit 1,378 Å, 1,334 Å bzw. 1,050 Å bestimmt wurde.[14] 1977 ergaben Untersuchungen mit Gasphasen-Elektronenbeugung, dass die C-C-Bindung von Pyrazin etwas größer als die von Benzol, aber ähnlich wie die von Pyridin ist. Dagegen war die C-N-Bindung von Pyrazin und Pyridin innerhalb der Fehlergrenze gleich. Es ist bemerkenswert, dass die C-H-Bindung von Pyrazin im Vergleich zu Benzol und Pyridin länger ist. Bei diesen Untersuchungen wurden die Werte bestimmt zu: r(C-C) = 1,339 ± 0,002 Å. r(C-N) = 1,403 ± 0,004 Å, r(C-H) = 1,115 ± 0,004 Å. C-C-N = 115,6 ± 0,4°, und C-C-H = 123,9 ± 0,6°.[15]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Pyrazin kann als Zwischenprodukt zur Herstellung anderer chemischer Verbindungen verwendet werden. So führt die vollständige Hydrierung des Pyrazins zu Piperazin. Die N-Alkylierung von Pyrazin ergibt Pyrazinium-Salze, die als ionische Flüssigkeiten dienen können. Pyrazin eignet sich als Ligand für Metallkomplexe, zur Herstellung von Koordinationspolymeren (z. B. Metall-organische Gerüstverbindungen[16]) sowie zum Aufbau supramolekularer Strukturen.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Eintrag zu Pyrazin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ a b c Datenblatt Pyrazin bei Alfa Aesar, abgerufen am 1. Juni 2010 (Seite nicht mehr abrufbar).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-448.
- ↑ a b Datenblatt Pyrazine bei Sigma-Aldrich, abgerufen am 22. April 2011 (PDF).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Amaron: CAS-Nr.: 642-04-6, EG-Nr.: 636-338-6, ECHA-InfoCard: 100.164.144, PubChem: 275938, ChemSpider: 242817, Wikidata: Q82040241.
- ↑ a b c d e f KOK TONG ONG, ZHI-QIANG LIU, MENG GUAN TAY: Review on the Synthesis of Pyrazine and Its Derivatives. In: Borneo Journal of Resource Science and Technology. 7, 2017, S. 60, doi:10.33736/bjrst.591.2017.
- ↑ a b c Gordon Bruce Barlin: The Pyrazines. John Wiley & Sons, 2009, ISBN 0-470-18869-3, S. 3 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Science of Synthesis: Houben-Weyl Methods of Molecular Transformations Vol. 16 Six-Membered Hetarenes with Two Identical Heteroatoms. Georg Thieme Verlag, 2014, ISBN 3-13-171881-1, S. 751 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ J. W. Brühl, Zeitschrift für physikalische Chemie, Stöchiometrie und Verwandtschaftslehre, 22, 373 (1897) (Spektrochemisches Verhalten der Iminoäther)
- ↑ Hans-Dieter Belitz, Werner Grosch: Lehrbuch der Lebensmittelchemie. Springer-Verlag, 2013, ISBN 978-3-662-08304-8, S. 328 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Yozo Ohtsuka, Eiko Tohma u. a.: Chemistry of diaminomaleonitrile. 5. Dihydropyrazine synthesis. In: The Journal of Organic Chemistry. 44, 1979, S. 4871, doi:10.1021/jo00394a027.
- ↑ a b Vishnu Ji Ram, Arun Sethi, Mahendra Nath, Ramendra Pratap: The Chemistry of Heterocycles Chemistry of Six to Eight Membered N,O, S, P and Se Heterocycles. Elsevier, 2019, ISBN 978-0-12-819211-5, S. 147 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b P. J. Wheatley: The crystal and molecular structure of pyrazine. In: Acta Crystallographica. 10, S. 182, doi:10.1107/S0365110X57000596.
- ↑ B.J.M. Bormans, G. De With, F.C. Mijlhoff: The molecular structure of pyrazine as determined from gas-phase electron diffraction data. In: Journal of Molecular Structure. 42, 1977, S. 121, doi:10.1016/0022-2860(77)87035-X.
- ↑ Farnoosh ZareKarizi, Monika Joharian, Ali Morsali: Pillar-layered MOFs: functionality, interpenetration, flexibility and applications. In: Journal of Materials Chemistry A. Band 6, Nr. 40, 2018, S. 19288–19329, doi:10.1039/C8TA03306D.


