Rubidiumsulfat
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
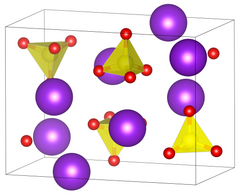
| ||||||||||||||||
| _ Rb+ _ S6+ _ O2− | ||||||||||||||||
| Kristallsystem |
orthorhombisch | |||||||||||||||
| Raumgruppe |
Pnma (Nr. 62) | |||||||||||||||
| Gitterparameter |
a = 780.1 pm, b = 596.5 pm, c = 1041.6 pm | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Rubidiumsulfat | |||||||||||||||
| Verhältnisformel | Rb2SO4 | |||||||||||||||
| Kurzbeschreibung |
weiße geruchlose Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 266,9 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
3,613 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
1700 °C[3] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−1443 kJ/mol[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Rubidiumsulfat ist das Rubidiumsalz der Schwefelsäure.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Rubidiumsulfat kann durch Salzbildungsreaktion aus Rubidiumhydroxid und Schwefelsäure hergestellt werden.
Auch aus Rubidiumcarbonat ist die Synthese möglich.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Rubidiumsulfat kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Pnma (Raumgruppen-Nr. 62) mit den Gitterparametern a = 780.1 pm, b = 596.5 pm, c = 1041.6 pm, und 4 Formeleinheiten pro Elementarzelle.[2] Die Kristalle sind mit den Kristallen von Kaliumsulfat isomorph.[6] Bei 657 °C wandelt es sich in eine andere Modifikation um.[6] Die Wasserlöslichkeit der Substanz nimmt mit steigender Temperatur zu, so lösen sich bei 0 °C 364 g und bei 100 °C 826 g Rubidumsulfat in 1 l Wasser.[6]
Die Standardbildungsenthalpie von Rubidiumsulfat beträgt −1443 kJ/mol, die Lösungswärme beträgt 27,88 kJ/mol.[5]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Durch elektrolytische Oxidation entsteht aus einer gesättigten Lösung von Rubidiumsulfat und Schwefelsäure bei niedriger Temperatur das Rubidiumpersulfat Rb2S2O8.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt Rubidium sulfate (PDF) bei Strem, abgerufen am 14. Oktober 2023.
- ↑ a b c d Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale. 4. Auflage. Band 3. Springer, 1997, ISBN 978-3-540-60035-0, S. 692 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Datenblatt Rubidiumsulfat bei Alfa Aesar, abgerufen am 24. Juni 2010 (Seite nicht mehr abrufbar).
- ↑ Datenblatt Rubidium sulfate bei Sigma-Aldrich, abgerufen am 9. Mai 2017 (PDF).
- ↑ a b M. de Forcrand: Sur les chlorures et sulfates de rubidium et de caesium. In: Compt. Rend. Hebd. Band 143, 1906, S. 98 (Volltext).
- ↑ a b c d R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie. Band 2. S. Hirzel, 1908, S. 431 (Volltext).

