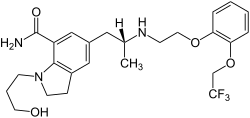
Silodosin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Silodosin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C25H32F3N3O4 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes bis schwach gelblich weißes Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 495,53 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
sehr leicht löslich in Essigsäure, leicht löslich in Ethanol und praktisch unlöslich in Wasser[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Silodosin (Handelsnamen: Urorec und Silodyx, Hersteller: Recordati Pharma GmbH) ist ein Arzneistoff, der zur symptomatischen Therapie von benigner Prostatahyperplasie (BPH, vergrößerte Prostatadrüse) angewendet wird.
Pharmakologische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Wirkungsmechanismus (Pharmakodynamik)
[Bearbeiten | Quelltext bearbeiten]Der Wirkstoff Silodosin ist ein α1-Adrenozeptorantagonist. Seine Funktionsweise beruht auf der Blockierung von Rezeptoren in der Prostatadrüse, der Blase und der Harnröhre, die als Alpha1A-Adrenozeptoren bezeichnet werden. Werden diese Rezeptoren aktiviert, bewirken sie eine Kontraktion der Muskeln, welche den Urinfluss regulieren. Indem diese Rezeptoren blockiert werden, ermöglicht Silodosin eine Entspannung dieser Muskeln, sodass die Urinabgabe erleichtert und die Symptome der BPH gelindert werden.[3][4] Im direkten Vergleich mit Tamsulosin erwies sich Silodosin als signifikant effektiver in der Reduktion dieses Symptomenkomplexes, besonders in der Subgruppe der Patienten, die zu Studienbeginn mindestens zwei Nykturie-Episoden pro Nacht aufwiesen.[5]
Klinische Angaben
[Bearbeiten | Quelltext bearbeiten]Unerwünschte Wirkungen (Nebenwirkungen)
[Bearbeiten | Quelltext bearbeiten]Die häufigste Nebenwirkung in den klinischen Studien waren retrograde Ejakulation (zumeist in milder Form, 23,6 %), gefolgt von Schwindel (2,1 %), orthostatischer Hypotonie (1,3 %), Kopfschmerzen (1,3 %), und Diarrhö (1,0 %). Gelegentlich traten verminderte Libido, Übelkeit, Mundtrockenheit oder erektile Dysfunktion auf.[6]
Wechselwirkungen mit anderen Medikamenten
[Bearbeiten | Quelltext bearbeiten]Silodosin wird in hohem Maße metabolisiert, vorwiegend über CYP3A4, Alkoholdehydrogenase und UGT2B7. Silodosin ist außerdem ein Substrat für P-Glykoprotein. Arzneimittel, die diese Enzyme und Transporter inhibieren oder induzieren, können die Konzentration von Silodosin und seines aktiven Metaboliten im Plasma beeinflussen.
Alphablocker: Da die Sicherheit der Anwendung von Silodosin in Kombination mit anderen α-Adrenorezeptor-Antagonisten bisher nicht ausreichend belegt wurde, wird eine gleichzeitige Anwendung mit anderen α-Adrenorezeptor-Antagonisten nicht empfohlen.
CYP3A4 Hemmer: In einer Wechselwirkungsstudie wurden bei gleichzeitiger Anwendung eines hoch wirksamen CYP3A4-Hemmers (Ketoconazol 400 mg) ein 3,7-facher Anstieg der maximalen Plasmakonzentration von Silodosin sowie ein 3,1-facher Anstieg der Silodosin-Exposition (d. h. AUC) beobachtet. Eine gleichzeitige Anwendung mit hoch wirksamen CYP3A4-Hemmern (wie Ketoconazol, Itraconazol oder Ritonavir) wird nicht empfohlen. Wurde Silodosin gleichzeitig mit einem mittelstarken CYP3A4-Hemmer wie Diltiazem angewendet, wurde ein Anstieg der AUC von Silodosin um rund 30 % beobachtet, während die und Plasmahalbwertszeit unbeeinflusst waren. Diese Veränderung besitzt keine klinische Relevanz, und eine Dosisanpassung ist nicht nötig.
PDE-5-Hemmer: Zwischen Silodosin und maximalen Dosen von Sildenafil oder Tadalafil wurden geringe pharmakodynamische Wechselwirkungen beobachtet. In einer placebokontrollierten Studie an 24 Probanden zwischen 45 und 78 Jahren, die mit Silodosin behandelt wurden, führte bei orthostatischen Tests (Stehen versus Liegen) die gleichzeitige Gabe von Sildenafil 100 mg oder Tadalafil 20 mg zu keiner klinisch bedeutsamen mittleren Senkung des systolischen oder diastolischen Blutdrucks. Bei Probanden über 65 Jahren wurden mittlere Blutdrucksenkungen zu verschiedenen Zeiten von 5 bis 15 mmHg (systolisch) und 0 bis 10 mmHg (diastolisch) gemessen. Positive orthostatische Tests traten während der kombinierten Gabe nur geringfügig häufiger auf; eine symptomatische Orthostase oder Schwindel war jedoch nicht zu beobachten. Patienten, die gleichzeitig PDE-5-Hemmer und Silodosin einnehmen, sollten auf mögliche Nebenwirkungen hin überwacht werden.
Antihypertensiva: Im klinischen Studienprogramm erhielten zahlreiche Patienten eine Begleittherapie mit Antihypertensiva (meist handelte es sich um Substanzen mit Wirkung auf das Renin-Angiotensin-System, Betablocker, Calciumantagonisten und Diuretika). Die Inzidenz einer orthostatischen Hypotonie erhöhte sich jedoch nicht. Dennoch sollte eine gleichzeitige Anwendung von Antihypertensiva mit Vorsicht begonnen und die Patienten auf mögliche Nebenwirkungen überwacht werden.
Digoxin: Die Steady state Spiegel von Digoxin, einem Substrat für P-Glykoprotein, wurden durch gleichzeitige Gabe von Silodosin 8 mg einmal täglich nicht signifikant verändert. Es ist keine Dosisanpassung erforderlich.
Zulassungsstatus
[Bearbeiten | Quelltext bearbeiten]Silodosin ist in den USA seit 2008 zugelassen.[7]
Für Silodosin gibt es seit Januar 2010 zwei zentrale Zulassungen in der EU:
In der Schweiz ist es seit 2016 zugelassen.[10]
Einschränkungen der Anwendung
[Bearbeiten | Quelltext bearbeiten]Der Zulassungsinhaber musste sich im Rahmen eines „Risk Management Plans (RMP)“ dazu verpflichten, dass alle Augenärzte in den Mitgliedstaaten, in denen Silodosin in den Verkehr gebracht wird, über den Zusammenhang zwischen Silodosin und einem intraoperativen Floppy-Iris-Syndrom (IFIS) informiert werden. Hintergrund ist die Beobachtung, dass während Kataraktoperationen bei manchen Patienten, die gleichzeitig oder in der Vorgeschichte mit α1-Blockern behandelt wurden, ein IFIS (eine Variante des Small-Pupil-Syndroms) beobachtet wurde. Dies kann während der Operation zu einer erhöhten Komplikationsrate führen.[9][11]
Studien
[Bearbeiten | Quelltext bearbeiten]- Watson USA: The Evaluation of the Safety of a New Drug for Benign Prostatic Hyperplasia Used for 9 Months. NCT00224133. Clinical Trials
- Watson USA: A New Drug for Benign Prostatic Hyperplasia (BPH) Compared With Placebo. NCT00224120. Clinical Trials
- Watson USA: A New Drug for Benign Prostatic Hyperplasia (BPH) Compared With Placebo. NCT00224107. Clinical Trials
- Recordati: Evaluation of the Efficacy and Safety of Silodosin in the Treatment of the Signs and Symptoms of BPH. NCT00359905. Clinical Trials
- Watson USA: A Study of Silodosin 8 mg Daily for the Treatment of Nocturia in Men With Benign Prostatic Hyperplasia. Clinical Trials
- Recordati: Profile of Silodosin. In: Eur Urol. Suppl 9, 2010, S. 491–495. PDF (Anmeldung erforderlich)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station, NJ, USA 2006, ISBN 0-911910-00-X.
- ↑ a b Datenblatt Silodosin, ≥98% (HPLC) bei Sigma-Aldrich, abgerufen am 5. November 2019 (PDF).
- ↑ S. Morishima, F. Suzuki, H. Yoshiki u. a.: Identification of the alpha1L-adrenoceptor in rat cerebral cortex and possible relationship between alpha1L- and alpha1A-adrenoceptors. In: British Journal of Pharmacology. Band 153, Nr. 7, April 2008, S. 1485–1494, PMID 18223667, PMC 2437907 (freier Volltext).
- ↑ S. Schilit, K. E. Benzeroual: Silodosin: a selective alpha1A-adrenergic receptor antagonist for the treatment of benign prostatic hyperplasia. In: Clinical Therapeutics. Band 31, Nr. 11, November 2009, S. 2489–2502, doi:10.1016/j.clinthera.2009.11.024, PMID 20109995.
- ↑ Francesco Montorsi: Corrigendum to “Profile of Silodosin”. In: European Urology. Band 59, Nr. 2, Februar 2011, S. 491–495, doi:10.1016/j.eururo.2010.11.014.
- ↑ K. Kobayashi, N. Masumori, R. Kato, S. Hisasue, R. Furuya, T. Tsukamoto: Orgasm is preserved regardless of ejaculatory dysfunction with selective alpha1A-blocker administration. In: International Journal of Impotence Research. Band 21, Nr. 5, 2009, S. 306–310, PMID 19536124, PMC 2834370 (freier Volltext).
- ↑ Drug Approval Package: RAPAFLO (Silodosin) NDA #022206. In: fda.gov. Food and Drug Administration, abgerufen am 31. März 2023.
- ↑ Öffentlicher Beurteilungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) zu: Silodyx.
- ↑ a b Öffentlicher Beurteilungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) zu: Urorec.
- ↑ (20526) Urorec, Pierre Fabre Pharma AG Neuaufnahme in die Spezialitätenliste per 1. September 2016. In: bag.admin.ch. Bundesamt für Gesundheit, abgerufen am 31. März 2023.
- ↑ Zusammenfassende Dokumentation über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage IX – Festbetragsgruppenbildung Alpha-Rezeptorenblocker, Gruppe 2, in Stufe 2 nach § 35 Absatz 1 SGB V. (PDF; 2,1 MB) G-BA, 18. August 2011, S. 20, abgerufen am 27. Mai 2017.
