Sumanen
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Kristallsystem | |||||||||||||
| Raumgruppe |
R3c (Nr. 161) | ||||||||||||
| Gitterparameter |
a = 16,6402 Å, c = 7,7024 Å[1] | ||||||||||||
| Allgemeines | |||||||||||||
| Name | Sumanen | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C21H12 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 264,32 g·mol−1 | ||||||||||||
| Schmelzpunkt |
115 °C[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Sumanen (nach Hindi सुमन ‚suman‘[4]) ist eine organische Verbindung, aus der Gruppe der polycyclischen aromatischen Kohlenwasserstoffe. Die Verbindung ist strukturell verwandt mit Corannulen und Buckminster-Fullerenen.
Darstellung
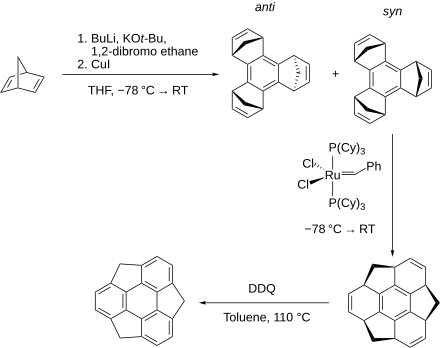
[Bearbeiten | Quelltext bearbeiten]Der erstmalige Syntheseversuch erfolgte 1993 ausgehend von Tris(bromomethyl)triphenylen, blieb allerdings erfolglos.[5] Erst zehn Jahre später gelang die erfolgreiche Darstellung der Verbindung in Lösung. Hierzu wurde Norbornadien mit Butyllithium, KOt-Bu und 1,2-Dibromethan unter starker Kühlung in THF umgesetzt, bei Raumtemperatur erfolgte die Zugabe von Kupfer(I)-iodid. Hierbei entstanden sowohl syn- als auch anti-Benzotris(norbornadien), wovon das syn-Produkt mittels des Grubbs I-Katalysators in der Kälte zu einem Zwischenprodukt umgesetzt wurde, aus dem nach Reaktion mit DDQ unter Erhitzen in Toluol Sumanen entstand.[6][7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Die Struktur besteht aus einem Benzolring, der alternierend von drei Benzol- und drei Cyclopentadienringen umgeben ist. Die Verbindung weist keine planare Struktur auf, stattdessen liegt ein schalenförmiges C3-symmetrisches Gerüst vor. Dessen Schalentiefe beträgt 1,1 Å bei einer Krümmung von 8.8°. Die Inversionsbarriere der Schalenstruktur liegt bei 19,6 kcal·mol−1, womit die Barriere deutlich höher als beim Corannulen liegt. Sumanen kristallisiert in der rhomboedrischen Raumgruppe R3c (Raumgruppen-Nr. 161) mit den Gitterkonstanten a = 16,6402 Å, c = 7,7024 Å.[1]
Die Schalen liegen in einer geschichteten Struktur vor, weshalb die Eignung zum anisotropen Ladungsträgertransport untersucht wird.[4][8]
Es sind einige Heterosumanene mit beispielsweise Stickstoff, Schwefel, Silizium aber auch Germanium oder Selen als Heteroatomen bekannt.[9]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Die Verbindung ist überwiegend von akademischem Interesse.
Analog zum Fluoren besitzt die Verbindung benzylische Position, an denen die Verbindung Alkylierungen und Aldol-Kondensationen unterlaufen kann. Anionen werden in entsprechenden Positionen stabilisiert, die Darstellung des Trianions ist durch schrittweise Zufuhr von t-BuLi möglich. Dementsprechend sind Derivatisierungen des Sumanens mit Elektrophilen möglich.[4]
Sumanen wird vereinzelt als Ligand verwendet. Die selektive Synthese von konkav gebundenem Sumanen gelang mittels des Komplexes [CpFe(Sumanen)][PF6], was laut den Autoren der erste Bericht über einen konkav bindenden schalenförmigen π-Komplex ist.[8] Weitere dargestellte Komplexe sind das Ruthenocen-Derivat [CpRu(η6‐Sumanen)][PF6] und das Zirconocen-Derivat [Cp(Sumanenyl)ZrCl2] (auch mit Cp*-Ligand), in denen eine Inversion zwischen konkaver und konvexer Koordination stattfindet.[10]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b H. Sakurai, T. Daiko, H. Sakane, T. Amaya, T. Hirao: CCDC 266603: Experimental Crystal Structure Determination. In: The Cambridge Crystallographic Data Centre. März 2005, doi:10.5517/cc8yf3q.
- ↑ Eintrag zu Sumanene bei TCI Europe, abgerufen am 8. April 2019.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c Jay S. Siegel, Yao-Ting Wu (Hrsg.): Polyarenes. Springer, 2014, ISBN 978-3-662-43379-9, S. 97–104 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 8. April 2019]).
- ↑ Goverdhan Mehta, Shailesh R. Shahk, K. Ravikumarc: Towards the design of tricyclopenta [def, jkl, pqr] triphenylene (‘sumanene’). A ‘bowl-shaped’ hydrocarbon featuring a structural motif present in C60(buckminsterfullerene). In: Journal of the Chemical Society, Chemical Communications. Band 0, Nr. 12, 1993, doi:10.1039/C39930001006.
- ↑ Hidehiro Sakurai, Taro Daiko, Toshikazu Hirao: A Synthesis of Sumanene, a Fullerene Fragment. In: Science. Band 301, Nr. 5641, September 2003, S. 1878, doi:10.1126/science.1088290.
- ↑ Shuhei Higashibayashi, Hidehiro Sakurai: Synthesis of Sumanene and Related Buckybowls. In: Chemistry Letters. Band 40, Nr. 2, 2011, S. 122–128, doi:10.1246/cl.2011.122.
- ↑ a b Toru Amaya, Toshikazu Hirao: Chemistry of Sumanene. In: The Chemical Record. Band 15, Nr. 1, 2015, S. 310–321, doi:10.1002/tcr.201402078.
- ↑ Qian Miao: Polycyclic Arenes and Heteroarenes. Synthesis, Properties, and Applications. John Wiley & Sons, 2015, ISBN 978-3-527-33847-4, Kap. 3, S. 68 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 8. April 2019]).
- ↑ Toshikazu Hirao (Hrsg.): Functionalized Redox Systems. Synthetic Reactions and Design of π- and Bio-Conjugates. Springer, 2015, ISBN 978-4-431-55306-9, 3.9, S. 102–104 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 8. April 2019]).