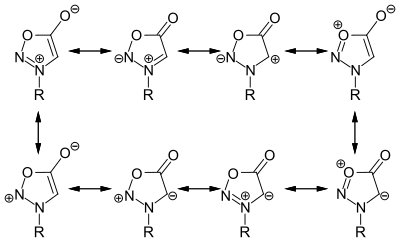
Sydnone
Sydnone sind mesoionische Heterocyclen. Sie leiten sich von 1,2,3-Oxadiazolen ab, die in 5-Position eine Ketogruppe tragen. Als mesoionische Struktur sind sie zwar insgesamt neutral, es lässt sich jedoch keine Resonanzstruktur ohne Ladungen formulieren. Erstmals wurden die Sydnone 1935 von John Campbell Earl und Alan W. Mackney beschrieben, nach deren Wirkungsort Sydney die Verbindungen benannt wurden.[1][2]
Struktur und Reaktivität
[Bearbeiten | Quelltext bearbeiten]Für die Sydnone lassen sich acht mögliche dipolare Grenzstrukturen formulieren, wobei in der Literatur die Darstellung der Grenzstrukturen mit einer negativen Ladung am exocyclischen Sauerstoffatom dominieren.[3]
Entgegen anfänglicher Annahmen handelt es sich bei Sydnonen nicht um Aromaten, sie sind jedoch durch Elektronen- und Ladungsdelokalisation stabilisiert.[4] Auch die ursprünglich angenommene negative Ladung am Keton in 5-Position in Form eines Enolats wurde widerlegt.[3]
Die Synthese von Sydnonen erfolgt durch Nitrosylierung von Aminosäurederivaten und anschließende Reaktion mit Essigsäureanhydrid.[3]
Anwendung
[Bearbeiten | Quelltext bearbeiten]Sydnone werden in [3+2]-Cycloadditionen verwendet. Dabei können substituierte Pyrazole hergestellt werden. Die erste Beschreibung dieser Reaktion wurde 1962 von Huisgen publiziert.[5]
Neben dem synthetischen Nutzen der Sydnonen, sind auch Medikamente mit einer Sydnon-Struktur, wie z. B. Molsidomin, bekannt. Diese wirken, indem sie Stickstoffmonoxid freisetzen.
Darüber hinaus können Sydnone am C4-Atom deprotoniert werden und so in ein N-heterocyclisches Carben überführt werden.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ J. Campbell Earl, Alan W. Mackney: 204. The action of acetic anhydride on N-nitrosophenylglycine and some of its derivatives. In: Journal of the Chemical Society (Resumed). 1935, S. 899, doi:10.1039/jr9350000899.
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 670 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Elodie Decuypère, Lucie Plougastel, Davide Audisio, Frédéric Taran: Sydnone–alkyne cycloaddition: applications in synthesis and bioconjugation. In: Chem. Commun. Band 53, Nr. 84, 2017, S. 11515–11527, doi:10.1039/C7CC06405E.
- ↑ Alfredo Mayall Simas, Joseph Miller, Petrônio Filgueiras de Athayade Filho: Are mesoionic compounds aromatic? In: Canadian Journal of Chemistry. Band 76, Nr. 6, 1. Juni 1998, S. 869–872, doi:10.1139/v98-065.
- ↑ R. Huisgen, R. Grashey, H. Gotthardt, R. Schmidt: 1,3-Dipolar Additions of Sydnones to Alkynes. A New Route into the Pyrazole Series. In: Angewandte Chemie International Edition in English. Band 1, Nr. 1, 27. Januar 1962, S. 48–49, doi:10.1002/anie.196200482.
- ↑ Tyll Freese, Jan C. Namyslo, Martin Nieger, Andreas Schmidt: Sulfur, mercury, and boron adducts of sydnone imine derived anionic N-heterocyclic carbenes. In: RSC Advances. Band 9, Nr. 9, 2019, S. 4781–4788, doi:10.1039/C9RA00294D.