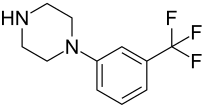
Trifluormethylphenylpiperazin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trifluormethylphenylpiperazin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C11H13F3N2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 230,23 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck |
0,25 Pa (25 °C)[3] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser (2,6 g·l−1)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Trifluormethylphenylpiperazin (TFMPP) ist eine organische, heterocyclische Verbindung. TFMPP ist ein Derivat des Piperazins. Wegen seiner psychoaktiven Wirkung taucht(e) es als Inhaltsstoff von Partydrogen auf.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Es tauchte auf als MDMA-Ersatz- bzw. Zusatzstoff in Ecstasy-Tabletten, insbesondere auch in Kombination mit Benzylpiperazin (BZP, A2). Weitere Piperazin-Derivate wurden als Inhaltsstoffe in Partydrogen gefunden, wie Methylendioxybenzylpiperazin (MDBP), meta-Chlorphenylpiperazin (mCPP) oder MeOPP. TFMPP ist weder in der chemischen Synthese, noch für industrielle Anwendungen von Bedeutung.
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]TFMPP bindet agonistisch an Serotonin-5-HT2C- und 5-HT1B-Rezeptoren.[4] Es bewirkt darüber hinaus eine relevante Ausschüttung von Serotoninreserven aus den Vesikeln.
TFMPP könnte geeignet sein, die Therapie des Alkoholismus zu unterstützen: es zeigt im Tierversuch einen hemmenden Einfluss auf die Resorption von Alkohol.[5]
Eine Ähnlichkeit des pharmakodynamischen Wirkprofils besteht mit Fenfluramin, das in Deutschland nicht mehr erhältlich ist.
Rechtsstatus
[Bearbeiten | Quelltext bearbeiten]In den USA veranlasste das Auftauchen von TFMPP in Partydrogen die Drug Enforcement Administration (DEA) im Jahr 2002, den Stoff vorsorglich in die Klasse I (Schedule I, hohes Potenzial an Missbrauch, kein nachgewiesener medizinischer Nutzen, illegal) aufzunehmen. Da sich aber das Missbrauchspotential als eher niedrig erwies, wurde im April 2004 das Verbot wieder aufgehoben.[6] In der EU wird der Handel mit TFMPP – soweit möglich – behördlicherseits kritisch beobachtet, in Dänemark wurde er bereits verboten.
- Schweiz: TFMPP wird mit Inkrafttreten der revidierten Betäubungsmittelverordnung von Swissmedic[7] per 1. Dezember 2010 dem Betäubungsmittelgesetz[8] unterstellt und somit ab diesem Zeitpunkt illegal. Einfuhr, Besitz, Vertrieb etc. werden nach dem Betäubungsmittelgesetz geahndet.
Stoffwechsel und Nachweis
[Bearbeiten | Quelltext bearbeiten]
Eine chemische Nachweisreaktion für TFMPP gibt es nicht, bislang sind auch keine immunologischen Methoden entwickelt worden. Der Nachweis ist daher nur mit Hilfe chromatographischer Methoden wie HPLC, HPLC-MS oder GC-MS möglich. Der Metabolismus von TFMPP ist seit 2003 bekannt.[9] Es kommt zur Hydroxylierung des Aromaten und daneben zur Zersetzung des Piperazinrings durch Desalkylierung an beiden Stickstoffatomen, und schließlich zur N-Hydroxylierung.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Georg Manolikakes, Andrei Gavryushin, Paul Knochel: An Efficient Silane-Promoted Nickel-Catalyzed Amination of Aryl and Heteroaryl Chlorides. In: The Journal of Organic Chemistry. Band 73, Nr. 4, 2008, S. 1429–1434, doi:10.1021/jo702219f.
- ↑ a b c d e Datenblatt 3-(Trifluormethyl)-N-phenylpiperazin bei Merck, abgerufen am 24. April 2011.
- ↑ a b Eintrag zu TFMPP in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ M.D. Schechter: Use of TFMPP stimulus properties as a model of 5-HT1B receptor activation. In: Pharmacol Biochem Behav., 31(1), 1988, S. 53–7. PMID 3252260.
- ↑ B.A. Johnson, N. Ait-Daoud: Neuropharmacological treatments for alcoholism: scientific basis and clinical findings. In: Psychopharmacology, 149, 2000, S. 327–344. PMID 10867960.
- ↑ U.S. Department of Justice, Drug Enforcement Administration (DEA), Scheduling Actions 2002 ( vom 20. Oktober 2008 im Internet Archive)
- ↑ Text der Betäubungsmittelverordnung Swissmedic mit Inkrafttreten per 1. Dezember 2010 als PDF.
- ↑ Text des schweizerischen Betäubungsmittelgesetzes als PDF. Relevante Strafbestimmungen: Art. 19 und folgende.
- ↑ R.F. Staack et al. (2003): New designer drug TFMPP: GC/MS and LC/MS studies on its phase I and II metabolism and on its toxicological detection in rat urine. In: J Mass Spectrom., 38(9), S. 971–81. PMID 14505325.
