Trimethylsilylisothiocyanat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trimethylsilylisothiocyanat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H9NSSi | ||||||||||||||||||
| Kurzbeschreibung |
klare, hellgelbe[1] Flüssigkeit | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 131,27 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in unpolaren Lösungsmitteln, z. B. n-Hexan oder Benzol[3] | ||||||||||||||||||
| Brechungsindex | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Trimethylsilylisothiocyanat kann als mit der Trimethylsilylgruppe geschützte, unbeständige Isothiocyansäure HNCS aufgefasst werden – die im tautomeren Gleichgewicht mit der ebenfalls unbeständigen Thiocyansäure HSCN steht. Die Verbindung ist Ausgangsstoff für Thiocyanate und Isothiocyanate, Thioharnstoffe und stickstoff- und schwefelhaltige (mit Ausnahme des 1,3,4-Oxadiazols) Heterocyclen.[4]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Trimethylchlorsilan reagiert mit überschüssigem Silberisothio-cyanat in inerten Lösungsmitteln bei 80 °C in ca. 85 % Rohausbeute zu Trimethylsilylisothiocyanat.[3] Präparativ vorteilhafter erscheint die Reaktion von wasserfreiem Natriumthiocyanat NaSCN in einem Soxhlet-Aufsatz mit siedendem Chlortrimethylsilan, bei der nach fraktionierter Destillation des Extraktionsgemisches Trimethylisocyanatosilan in 78 %iger Ausbeute entsteht.[5]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Trimethylsilylisothiocyanat ist eine klare farblose bis hellgelbe und unangenehm stechend riechende Flüssigkeit, die mit Wasser unter Zersetzung reagiert.[1] Mit Ethanol bildet sich unbeständige Isothiocyansäure, die sich rasch weiter umsetzt.[6]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Thiocyanate und Isothiocyanate
[Bearbeiten | Quelltext bearbeiten]Trimethylsilylisothiocyanat eignet sich als Reagenz zur Einführung von Thiocyanat- und Isothiocyanatgruppen sowie von funktionellen stickstoffhaltigen Heterocyclen.
So sind Alkylthiocyanate unter milden Reaktions-bedingungen in teils sehr guten Ausbeuten (> 90 %) durch Reaktion von TMSNCS mit Alkylhalogeniden in Gegenwart des Phasentransferkatalysators Tetrabutylammoniumfluorid n-Bu4NF zugänglich.[7]

Die Umsetzung von TMSNCS mit Aldehyden, wie z. B. Isobutanal liefert in Gegenwart katalytischer Mengen der Lewis-Säure Zinkchlorid ZnCl2 über das cyclische Trioxan-Trimer in hoher Ausbeute (89 %) einen α,α'-Di-isothiocyanatoether.[8]

Stickstoffhaltige fünfgliedrige Heterocyclen
[Bearbeiten | Quelltext bearbeiten]In einer Variante der Hantzschschen Thiazolsynthese wird mit Trimethylsilylisothiocyanat und aromatischen bzw. primären und sekundären aliphatischen Aminen substituierte Thioharnstoffe gebildet, die mit α-Bromcarbonylverbindungen zu 2-Aminothiazolen cyclisiert werden können. Als Mehrkomponentenreaktion kann diese Umsetzung auch durch Zugabe von TMSNCS, der Base Triethylamin und einem Amin zu einem α-Bromketon in Ethanol durchgeführt werden.[6]
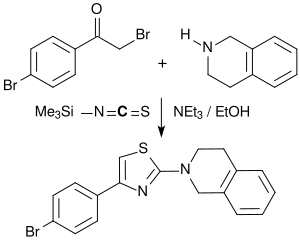
2-Aminothiazole sind vielseitige Synthesebausteine für Pharmawirkstoffe,[9] wie z. B. der H2-Rezeptor-Antagonist Famotidin, das Cephalosporin-Antibiotikum Cefdinir, das nichtsteroidale Antirheumatikum Meloxicam oder der Proteinkinaseinhibitor Dasatinib.
3-Mercapto-1,2,4-triazole entstehen bei der Reaktion von TMSNCS mit Carbonsäurehydraziden über die Zwischenstufe der Thiosemicarbazide durch deren Cyclisierung mittels Natronlauge.[10]
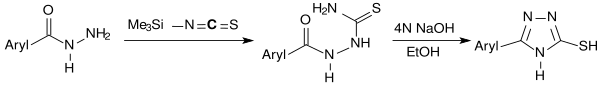
3-Mercapto-1,2,4-triazole sind Bausteine für Wirkstoffe unterschiedlicher pharmakologischer Aktivität.[11]
2-Amino-1,3,4-thiadiazole sind in einer Eintopfreaktion von TMSNCS mit Säurehydraziden in Ethanol in Gegenwart von konzentrierter Schwefelsäure in hohen Ausbeuten zugänglich.[12]
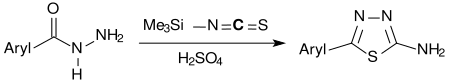
2-Amino-1,3,4-thiadiazol ist das Grundgerüst für den Carboanhydrasehemmer Acetazolamid, das Nitroimidazol Megazol gegen die Chagas-Krankheit und die afrikanische Trypanosomiasis, sowie für antimikrobielle Substanzen[13] mit anderen Wirkspektren.
Analog dazu sind 2-Amino-1,3,4-oxadiazole durch Eintopfreaktion von TMSNCS mit Säurehydraziden in Ethanol und Zugabe einer alkalischen Iod/Kaliumiodid-Lösung, wobei das intermediär entstehende Thiosemicarbazid unter Cyclisierung und Schwefelabspaltung (Cyclodesulfurierung) in hoher Ausbeute in das entsprechende Aminooxadiazol übergeht.[14]
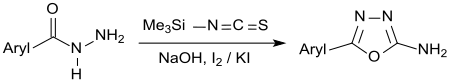
Derivate des 2-Amino-1,3,4-oxadiazol zeigen ebenfalls vielfältige pharmakologische Eigenschaften.[14]
Weitere Reaktionen von TMSNCS zur Einführung der Isocyanatgruppe, z. B. bei der Umwandlung von Alkenen in Diisocyanate[15] sind berichtet.[10]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Datenblatt Trimethylsilylisothiocyanat bei Sigma-Aldrich, abgerufen am 25. August 2018 (PDF).
- ↑ a b Patent GB643941: Improvements in and relating to organo-silicon compounds. Angemeldet am 27. September 1950, veröffentlicht am 9. Juni 1948, Anmelder: The British Thomson-Houston Co. Ltd..
- ↑ a b c H.H. Anderson: Methyl silicon isothiocyanates. Molar refractions. In: J. Am. Chem. Soc. Band 69, Nr. 12, 1947, S. 3049–3051, doi:10.1021/ja01204a036.
- ↑ R.H.C.N. Freitas: Trimethylsilyl Isothiocyanate (TMSNCS). In: Austr. J. Chem. Band 69, Nr. 8, 2016, S. 928–929, doi:10.1071/CH16057.
- ↑ Patent GB643941: Improvements in and relating to organo-silicon compounds. Angemeldet am 9. Juni 1948, veröffentlicht am 27. September 1950, Anmelder: The British Thomson-Houston Co. Ltd..
- ↑ a b V. Golubev, F. Zubkov, M. Krasavin: A simple, three-component synthesis of 2-aminothiazoles using trimethylsilyl isothiocyanate. In: Tetrahedron Lett. Band 54, 2013, S. 4844–4847, doi:10.1016/j.tetlet.2013.06.102.
- ↑ P.-Y. Renard, H. Schwebel, P. Vayron, E. Leclerc, S. Dias, C. Mioskowski: Optimized access to alkyl thiocyanates. In: Tetrahedron Lett. Band 42, Nr. 48, 2001, S. 8479–8481, doi:10.1016/S0040-4039(01)01846-9.
- ↑ K. Nishiyama, M. Oba: Reactions of trimethylsilyl isothiocyanate with aldehydes and acetals. Synthesis of symmetrically and unsymmetrically isothiocyanato-substituted ethers. In: Bull. Chem. Soc. Jpn. Band 60, Nr. 6, 1987, S. 2289–2291, doi:10.1246/bcsj.60.2289.
- ↑ D. Das, P. Sikdar, M. Bairaqi: Recent developments of 2-amino-thiazoles in medicinal chemistry. In: Eur. J. Med. Chem. Band 109, 2016, S. 89–98, doi:10.1016/j.ejmech.2015.12.022.
- ↑ a b D.R. Guda, T. Wang, H.M. Cho, M.E. Lee: Trimethylsilyl isothiocyanate (TMSNCS): an efficient reagent for the one-pot synthesis of mercapto-1,2,4-triazoles. In: Tetrahedron Lett. Band 53, Nr. 39, 2012, S. 5238–5242, doi:10.1016/j.tetlet.2012.07.054.
- ↑ R.M. Shaker: The chemistry of mercapto- and thione- substituted 1,2,4-triazoles and their utility in heterocyclic synthesis. In: ARKIVOC. Band 9, 2006, S. 59–112, doi:10.3998/ark.55550190.0007.904.
- ↑ D.R. Guda, H.M. Cho, M.E. Lee: Mild and convenient one-pot synthesis of 2-amino-1,3,4-thiadiazoles using trimethylsilyl isothiocyanate (TMSNCS). In: RSC Adv. Band 3, 2013, S. 6813–6816, doi:10.1039/c3ra00159h.
- ↑ G. Serban, O. Stanasel, E. Serban, S. Bota: 2-Amino-1,3,4-thiadiazoles as a potential scaffold for promising antimicrobial agents. In: Drug Des. Dev. Ther. Band 12, 2018, S. 1545–1566, doi:10.2147/DDDT.S155958h.
- ↑ a b D.R. Guda, H.M. Cho, M.E. Lee: Mild and convenient one-pot synthesis of 2-amino-1,3,4-oxadiazoles promoted by trimethylsilyl isothiocyanate (TMSNCS). In: RSC Adv. Band 3, 2013, S. 7684–7687, doi:10.1039/c3ra41044g.
- ↑ M. Bruno, R. Margarita, L. Parlanti, G. Piancatelli, M. Trifoni: Hypervalent iodine chemistry: Novel and direct thiocyanation of alkenes using [bis(acetoxy)iodo]benzene/trimethylsilyl isothiocyanate reagent combination. Synthesis of 1,2-dithiocyanates. In: Tetrahedron Lett. Band 39, Nr. 22, 1998, S. 3847–3848, doi:10.1016/S0040-4039(98)00629-7.


