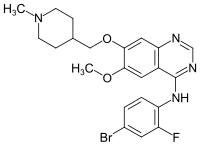
Vandetanib
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Vandetanib | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C22H24BrFN4O2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 475,36 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Vandetanib, das unter dem Markennamen Caprelsa vertrieben wird, ist ein Krebsmedikament, das zur Behandlung bestimmter Tumoren der Schilddrüse eingesetzt wird.[2][3][4] Es wirkt als Kinase-Inhibitor einer Reihe von Zellrezeptoren, hauptsächlich des vaskulären endothelialen Wachstumsfaktor-Rezeptors (VEGFR), des EGF-Rezeptors und der RET-Tyrosin-Kinase.[5][6]
Das Medikament wurde von AstraZeneca entwickelt,[2] die 2015 die Rechte an Sanofi Genzyme verkauften.
Entwicklung und Vermarktung
[Bearbeiten | Quelltext bearbeiten]Vandetanib wurde im April 2011 von der FDA für die Behandlung von Schilddrüsenkrebs im Spätstadium zugelassen und wurde zunächst ohne Handelsnamen vermarktet; seit August 2011 wird es unter dem Handelsnamen Caprelsa vermarktet. Im Februar 2012 folgte die bedingte Zulassung in der EU.[7]
Im Jahr 2015 erwarb Sanofi Genzyme das Produkt von AstraZeneca.[8][9][10]
AstraZeneca testete Vandetanib auch in der Kombinationstherapie des nicht-kleinzelligen Lungenkrebs in klinischen Studien. Einen im Juni 2009 gestellten Zulassungsantrag bei der EMA zog AstraZeneca jedoch vier Monate später zurück, da die Studien keinen ausreichenden Nutzen gezeigt hatten.[11] Die Ergebnisse einer prospektiven, randomisierten, doppelblinden, multizentrischen Phase-2-Studie, die 2017 veröffentlicht wurde, zeigten keine Verbesserung im Gesamtüberleben bei lokal fortgeschrittenem oder metastasiertem Pankreaskarzinom, wenn die Patienten zusätzlich zu Gemcitabin auch Vandetanib erhielten.[12]
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]
Vandetanib ist ein Inhibitor von vaskulärem endothelialen Wachstumsfaktor-Rezeptor-2, epidermalem Wachstumsfaktor-Rezeptor und RET-Tyrosinkinasen. Es hemmt VEGFR-3 schwach.[3][14]
Nach oraler Gabe wird Vandetanib gut aus dem Darm resorbiert, erreicht 4 bis 10 Stunden nach der Anwendung maximale Blutplasmakonzentrationen und hat eine Halbwertszeit von durchschnittlich 19 Tagen. Es muss etwa drei Monate lang eingenommen werden, um eine Steady-State-Konzentration zu erreichen. Im Blut ist es fast vollständig (90–96 %) an Plasmaproteine wie Albumin gebunden. Es wird über CYP3A4 zu N-Desmethylvandetanib und über FMO1 und 3 zu Vandetanib-N-Oxid metabolisiert. Dies sind beides aktive Metaboliten. Vandetanib wird über die Fäzes (44 %) und den Urin (25 %) in Form von unverändertem Wirkstoff und der Metaboliten ausgeschieden.[6][13][15]
Anwendungsbeschränkungen
[Bearbeiten | Quelltext bearbeiten]Nicht angewendet werden darf Vandetanib bei einem QTc-Intervall über 480 Millisekunden oder beim Vorliegen eines kongenitalen Long-QTc-Syndroms, ferner nicht gemeinsam mit Arzneimitteln, die bekanntermaßen ebenfalls das QTc-Intervall verlängern und/oder Torsade de pointes auslösen.[2][6]
Nicht empfohlen wird die Verwendung von Vandetanib bei Patienten mit mittelschwerer und schwerer Leberfunktionsstörung, da die Sicherheit und Wirksamkeit noch nicht nachgewiesen ist.[16]
Im Januar 2023 wurde durch einen Rote-Hand-Brief mitgeteilt, dass Vandetanib nicht bei Patienten angewendet werden sollte, deren RET-Mutationsstatus (Rearranged-during-Transfection-Mutation, V804M-Mutation im RET-Gen) unklar oder negativ ist.[17] Bei diesen Patienten hat Vandetanib möglicherweise einen geringeren Nutzen.[4] Falls solche Patienten bereits mit Vandetanib behandelt werden, empfiehlt der Hersteller, die Behandlung abzubrechen.[17]
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Sehr häufige (bei mehr als 10 % der Behandelten) unerwünschte Wirkungen sind Erkältungen, Bronchitis, Infektionen der oberen Atemwege, Harnwegsinfektionen, verminderter Appetit, geringe Kalziumabsorption, Schlaflosigkeit, depressive Stimmung, Kopfschmerzen, Kribbeln, seltsame, schmerzhafte Empfindungen, Schwindel, verschwommenes Sehen, Hornhautschäden, QT-Syndrom, Bluthochdruck, Magenschmerzen, Durchfall, Übelkeit, Erbrechen, Verdauungsstörungen, Photoallergische Dermatitis, Hautausschlag, Akne, trockene und juckende Haut, Nagelstörungen, Eiweiß im Urin, Nierensteine, Schwäche, Müdigkeit, Schmerzen und Ödeme.[3]
Häufige (bei 1 % bis 10 % der Behandelten) unerwünschte Wirkungen sind Lungenentzündung, Sepsis, Grippe, Blasenentzündung, Nasennebenhöhlenentzündung, Kehlkopfentzündung, Follikulitis, Furunkel, Pilzinfektionen, Niereninfektionen, niedrige Schilddrüsenhormonwerte, niedrige Kaliumwerte, hohe Kalziumwerte, Hyperglykämie, Dehydrierung, niedrige Natriumwerte, Angstzustände, Zittern, Lethargie, Bewusstseinsverlust, Gleichgewichtsstörungen, Veränderungen des Geschmackssinns, Sehstörungen, wahrgenommene Lichtblitze, Glaukom, Konjunktivitis, trockenes Auge, Keratopathie, hypertensive Krise, Mini-Schlaganfälle, Nasenbluten, Bluthusten, Blut im Stuhlgang, Kolitis, Mundtrockenheit, Stomatitis, Verstopfung, Gastritis, Gallensteine, Hand-Fuß-Syndrom, Haarausfall, schmerzhaftes Wasserlassen, blutiger Urin, Nierenversagen, häufiges Wasserlassen, dringender Harndrang und Fieber.[3]
Wechselwirkungen
[Bearbeiten | Quelltext bearbeiten]Vandetanib wurde als Substrat für die Transporter OATP1B1 und OATP1B3 beschrieben. Die Interaktion von Vandetanib mit OATP1B1 und OATP1B3 kann seine hepatische Disposition verändern und zu Transporter-vermittelten Arzneimittelwechselwirkungen führen.[16] Außerdem ist Vandetanib ein Inhibitor des OATP1B3-Transporters, aber nicht für OATP1B1.[18]
Andere Arzneimittel, die das QT-Intervall verlängern, können diese Nebenwirkung von Vandetanib möglicherweise noch verstärken. Da das Medikament teilweise über das Leberenzym CYP3A4 verstoffwechselt wird, können starke Induktoren dieses Enzyms die Blutplasmakonzentrationen von Vandetanib verringern. CYP3A4-Inhibitoren erhöhen die Vandetanib-Konzentrationen nicht signifikant, vermutlich weil es auch über die flavinhaltige Monooxygenase 1 (FMO1) und 3 verstoffwechselt wird.[2][6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von (4-Bromo-2-fluoro-phenyl)-[6-methoxy-7-(1-methyl-piperidin-4-ylmethoxy)-quinazolin-4-yl]-amine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 20. Februar 2021.
- ↑ a b c d DailyMed - CAPRELSA- vandetanib tablet, film coated. Abgerufen am 19. Februar 2021 (englisch).
- ↑ a b c d Caprelsa 100 mg & 300 mg film coated tablets - Summary of Product Characteristics (SmPC) - (emc). Archiviert vom (nicht mehr online verfügbar) am 28. Februar 2017; abgerufen am 19. Februar 2021 (englisch).
- ↑ a b David Viola, Laura Valerio, Eleonora Molinaro, Laura Agate, Valeria Bottici: Treatment of advanced thyroid cancer with targeted therapies: ten years of experience. In: Endocrine-Related Cancer. Band 23, Nr. 4, 1. April 2016, S. R185–R205, doi:10.1530/ERC-15-0555.
- ↑ vandetanib. 2. Februar 2011, abgerufen am 19. Februar 2021 (englisch).
- ↑ a b c d Vandetanib Monograph for Professionals. Abgerufen am 19. Februar 2021 (englisch).
- ↑ EPAR - Caprelsa. In: ema.europa.eu. Abgerufen am 22. Februar 2021.
- ↑ Sanofi to Buy Caprelsa Drug from AstraZeneca for $300 Million. In: Bloomberg.com. 27. Juli 2015 (englisch, bloomberg.com [abgerufen am 19. Februar 2021]).
- ↑ AZ sells rare cancer drug to Sanofi. 27. Juli 2015, abgerufen am 19. Februar 2021 (englisch).
- ↑ Genzyme to Buy Caprelsa from AstraZeneca for Up to $300M. In: GEN - Genetic Engineering and Biotechnology News. 27. Juli 2015, abgerufen am 19. Februar 2021 (amerikanisches Englisch).
- ↑ Zactima: Withdrawal of the marketing authorisation application. Abgerufen am 19. Februar 2021 (englisch).
- ↑ Gary Middleton et al.: Vandetanib plus gemcitabine versus placebo plus gemcitabine in locally advanced or metastatic pancreatic carcinoma (ViP): a prospective, randomised, double-blind, multicentre phase 2 trial. In: The Lancet Oncology. Band 18, 2017, S. 486–499, doi:10.1016/S1470-2045(17)30084-0.
- ↑ a b CLINICAL PHARMACOLOGY AND BIOPHARMACEUTICS REVIEW(S). CENTER FOR DRUG EVALUATION AND RESEARCH, abgerufen am 19. Februar 2021 (englisch).
- ↑ Francesca Carlomagno, Donata Vitagliano, Teresa Guida, Fortunato Ciardiello, Giampaolo Tortora: ZD6474, an Orally Available Inhibitor of KDR Tyrosine Kinase Activity, Efficiently Blocks Oncogenic RET Kinases. In: Cancer Research. Band 62, Nr. 24, 15. Dezember 2002, S. 7284–7290, PMID 12499271 (englisch, aacrjournals.org [abgerufen am 19. Februar 2021]).
- ↑ Paul Martin, Stuart Oliver, Sarah-Jane Kennedy, Elizabeth Partridge, Michael Hutchison: Pharmacokinetics of vandetanib: three phase I studies in healthy subjects. In: Clinical Therapeutics. Band 34, Nr. 1, Januar 2012, S. 221–237, doi:10.1016/j.clinthera.2011.11.011, PMID 22206795.
- ↑ a b Varun Khurana, Mukul Minocha, Dhananjay Pal, Ashim K. Mitra: Role of OATP-1B1 and/or OATP-1B3 in hepatic disposition of tyrosine kinase inhibitors. In: Drug metabolism and drug interactions. Band 29, Nr. 3, 2014, S. 179–190, doi:10.1515/dmdi-2013-0062, PMID 24643910, PMC 4407685 (freier Volltext).
- ↑ a b Sanofi: Rote-Hand-Brief zu Caprelsa® (Vandetanib): Einschränkung der Indikation. BfArM, 2. Januar 2023, abgerufen am 2. Januar 2023.
- ↑ Varun Khurana, Mukul Minocha, Dhananjay Pal, Ashim K. Mitra: Inhibition of OATP-1B1 and OATP-1B3 by tyrosine kinase inhibitors. In: Drug metabolism and drug interactions. Band 29, Nr. 4, 2014, S. 249–259, doi:10.1515/dmdi-2014-0014, PMID 24807167, PMC 4407688 (freier Volltext) – (englisch).