Bromethalin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bromethalin | ||||||||||||||||||
| Andere Namen |
N-Methyl-2,4-dinitro-6-(trifluormethyl)-N-(2′,4′,6′-tribromphenyl)anilin | ||||||||||||||||||
| Summenformel | C14H7Br3F3N3O4 | ||||||||||||||||||
| Kurzbeschreibung |
weißer bis schwach gelblicher geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 577,93 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,36 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
zersetzt sich vor dem Sieden[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Bromethalin ist eine chemische Verbindung aus der Gruppe der Aniline.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Bromethalin kann durch eine mehrstufige Reaktion von Toluol mit Chlor, Fluorwasserstoff, Salpetersäure, Anilin, Dimethylsulfat und Dibromisocyanursäure gewonnen werden,[5] siehe folgendes Syntheseschema:
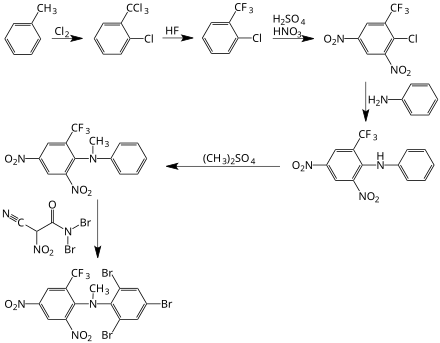
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Bromethalin ist ein weißer geruchloser Feststoff, der unlöslich in Wasser ist und sich unter Einwirkung von UV-Licht zersetzt.[1]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Bromethalin wird als Rodentizid verwendet.[1] Es wurde 1985 auf den Markt gebracht. Bromethalin gehört nicht zur Wirkstoffgruppe der Vitamin-K-Antagonisten (wie die 4-Hydroxycumarine Warfarin und Bromadiolon).[6] Nach der Aufnahme wird es in der Leber zum größten Teil zu Desmethylbromethalin umgewandelt, welches bedeutend toxischer ist als die Ausgangssubstanz. Dieses entkoppelt die oxidative Phosphorylierung in den Mitochondrien der Zellen, wodurch Ödeme vor allem in Gehirn und Rückenmark entstehen.[4][7]
Zulassung[Bearbeiten | Quelltext bearbeiten]
In den Staaten der EU, unter anderem in Deutschland und Österreich, sowie in der Schweiz sind keine Pflanzenschutzmittel mit diesem Wirkstoff zugelassen.[8]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h Eintrag zu Bromethalin in der Hazardous Substances Data Bank (via PubChem), abgerufen am 27. September 2012.
- ↑ a b c Eintrag zu Bromethalin in der Pesticide Properties DataBase (PPDB) der University of Hertfordshire, abgerufen am 14. März 2023.
- ↑ a b Datenblatt Bromethalin bei Sigma-Aldrich, abgerufen am 14. März 2023 (PDF).
- ↑ a b c vetpharm: Bromethalin bei Kleintieren, abgerufen am 4. Juni 2021.
- ↑ Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, 1996, ISBN 0-8155-1853-6, S. 861 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eric Dunayer: Bromethalin: The other rodenticide ( vom 5. Mai 2014 im Internet Archive) (PDF; 181 kB). In: Veterinary Medicine, September 2003. S. 732–736.
- ↑ Terry R. Roberts, David H. Hutson, Philip W. Lee, Peter H. Nicholls: Metabolic Pathways of Agrochemicals: Part 2: Insecticides and Fungicides. Royal Society of Chemistry, 1999, ISBN 0-85404-499-X, S. 908 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Bromethalin in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 25. Februar 2016.

