Valeriansäureethylester
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Valeriansäureethylester | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C7H14O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit fruchtigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 130,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser (2,23 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,399 (20 °C, 589 nm)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Valeriansäureethylester ist eine chemische Verbindung aus der Gruppe der Carbonsäureester.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Valeriansäureethylester kommt natürlich in Äpfeln, Bananen, der Moschus-Erdbeere und anderen Naturprodukten vor.[5][6]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
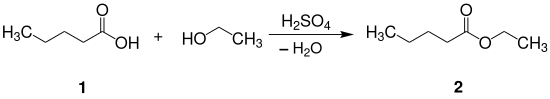
Valeriansäureethylester 2 kann durch Reaktion von Valeriansäure 1 mit Ethylalkohol in Gegenwart von Schwefelsäure gewonnen werden.[3][5]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Valeriansäureethylester ist eine farblose, entzündbare Flüssigkeit mit fruchtigem Geruch, die schwer löslich in Wasser ist. Sie besitzt eine dynamische Viskosität von 0,8 mPa·s bei einer Temperatur von 20 °C.[2]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Valeriansäureethylester wird mit seinem Geruch nach grünen Äpfeln als weitverbreiteter Aromastoff verwendet.[7] In der organischen Synthese wird die Verbindung in nucleophilen Substitutionen, in α-Alkylierungen sowie in Heterocyclensynthesen eingesetzt.[3]
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Die Dämpfe von Valeriansäureethylester bilden mit Luft beim Erhitzen des Stoffes über seinen Flammpunkt (Flammpunkt: 36 °C, Zündtemperatur: 400 °C) oder bei erhöhter Umgebungstemperatur explosive Gemische.[2]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu ETHYL VALERATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Januar 2021.
- ↑ a b c d e f g h i j k l m n Eintrag zu CAS-Nr. 539-82-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. April 2018. (JavaScript erforderlich)
- ↑ a b c d e f Eintrag zu Pentanoate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. April 2018.
- ↑ Datenblatt Valeriansäureethylester bei Merck, abgerufen am 18. Dezember 2012.
- ↑ a b George A. Burdock: Fenaroli’s Handbook of Flavor Ingredients: George A. Burdock. CRC Press, 2005, ISBN 0-8493-3034-3, S. 638 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Friedrich Drawert, Roland Tressl, Günter Staudt, Hans Köppler: Gaschromatographisch-massenspektrometrische Differenzierung von Erdbeerarten. In: Zeitschrift für Naturforschung C. 28, 1973, S. 488–493 (PDF, freier Volltext).
- ↑ A. K. Haghi: Food Science: Research and Technology. CRC Press, 2011, ISBN 1-926895-01-0, S. 4 (eingeschränkte Vorschau in der Google-Buchsuche).
