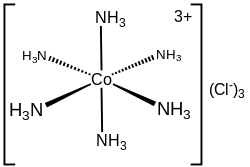
Hexaammincobalt(III)-chlorid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Hexaammincobalt(III)-chlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | [Co(NH3)6]Cl3[1] | ||||||||||||||||||
| Kurzbeschreibung |
oranger geruchloser Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 267,48 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte |
1,71 g·cm−3[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Hexaammincobalt(III)-chlorid ist eine chemische Verbindung aus der Gruppe der Amminkomplexe und Chloride. Die Verbindung gehört zu den noch heute nach Alfred Werner benannten Werner-Komplexen, zu denen unter anderem auch die verwandten Hexaammincobalt(III)-nitrat, Hexaammincobalt(II)-iodid und Hexaammincobalt(III)-iodid gehören.[5]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Hexaammincobalt(III)-chlorid kann durch Reaktion von Cobalt(II)-chlorid-Hexahydrat mit Ammoniumchlorid und Ammoniak in einem Luftstrom gewonnen werden.[3]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]

Hexaammincobalt(III)-chlorid ist ein oranger[2], wein- oder bräunlichroter geruchloser kristalliner Feststoff, der wenig löslich in Wasser ist. Beim Kochen in Wasser entsteht Cobalt(II)-hydroxid.[3] Bei Temperaturen über 215 °C erfolgt Zersetzung unter Ammoniakabgabe.[6] Die Verbindung wurde 1798 von Citoyen Tassaert entdeckt.[7]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Hexaammincobalt(III)-chlorid wird in der Biochemie verwendet.[8]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Inorganic Compounds, S. 4-60.
- ↑ a b c d e f Datenblatt Hexaammincobalt(III) chloride, 99% bei Alfa Aesar, abgerufen am 18. August 2013 (Seite nicht mehr abrufbar).
- ↑ a b c Georg Brauer: Handbuch der präparativen anorganischen Chemie. 3., umgearb. Auflage. Band 3. Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1675.
- ↑ Datenblatt Hexaamminecobalt(III) chloride, 99% bei Sigma-Aldrich, abgerufen am 18. August 2013 (PDF).
- ↑ uni-freiburg: Chemie der Metalle, Kap. 8.3.
- ↑ Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis, 2011, ISBN 1-4398-1462-7, S. 196 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Lutz H. Gade: Koordinationschemie. John Wiley & Sons, 2012, ISBN 3-527-66394-0, S. 20 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ J. R. Rusche, P. Howard-Flanders: Hexamine cobalt chloride promotes intermolecular ligation of blunt end DNA fragments by T4 DNA ligase. In: Nucleic acids research. Band 13, Nummer 6, März 1985, S. 1997–2008, PMID 4000951, PMC 341130 (freier Volltext).



![{\displaystyle \mathrm {4\ [Co(NH_{3})_{6}]Cl_{3}+2\ H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9caa0981b5e3b898e1caa1f6f1602b10ef11f072)