Kritische Mizellbildungskonzentration
In der Chemie beschreibt die Kritische Mizellbildungskonzentration, oder CMC (englisch critical micelle concentration), die Konzentration eines Tensids, ab der sich Mizellen bilden. Bei einer weiteren Erhöhung der Konzentration gehen nahezu alle hinzukommenden Moleküle in Mizellen über.[1]
Die CMC ist eine charakterisierende Eigenschaft von Tensiden, wie sie in Waschmitteln, Seifen etc. verwendet werden.
Verhalten von Tensiden bei verschiedenen Konzentrationen[Bearbeiten | Quelltext bearbeiten]
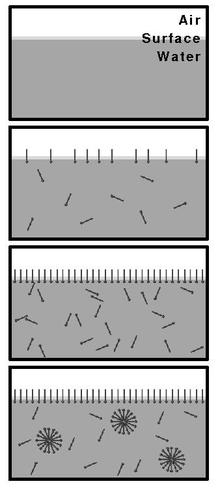
Bei einer Konzentration von oberflächenaktiven Substanzen (wie Tensiden) unterhalb der CMC bewegen sich die Moleküle frei und einzeln in der Flüssigkeit (als Monomer) und positionieren sich bevorzugt mit ihrem hydrophoben Molekülteil an der freien Oberfläche. Bei Konzentrationen unterhalb der CMC nimmt die Oberflächenspannung der Flüssigkeit mit steigender Konzentration der Tenside ab. Wenn die CMC erreicht ist, beginnen die Tensidmoleküle Mizellen zu bilden. Wird die Konzentration weiter erhöht, steigt die Anzahl der gebildeten Mizellen. Da die zur Verfügung stehenden „Positionen“ an den Grenzflächen der Flüssigkeit spätestens mit Erreichen der CMC erschöpft sind, nehmen die Tenside nun keinen weiteren Einfluss auf die freie Oberfläche der Flüssigkeit und die Oberflächenspannung bleibt – in einem idealen System – oberhalb der CMC konstant.
Die CMC ist abhängig von
- der Ionenstärke und dem Aufbau der Kopfgruppe des Tensids sowie der Länge und Form der lipophilen Kohlenwasserstoffkette,
- vom Dispersionsmittel (meist Wasser) sowie dessen Druck und Temperatur,[2]
- der Anwesenheit von weiteren oberflächenaktiven Substanzen oder Elektrolyten,
- der Menge der vorhandenen Grenzflächen.
Die CMC sinkt mit steigender Ionenstärke.[3] Mizellen bilden sich nur oberhalb des Temperaturbereichs des Krafft-Punkts.
Bei einem kompakten Volumen hat die Ausdehnung der vorhandenen Grenzflächen nur einen geringen Einfluss auf die CMC. Wird aber etwa durch das Einblasen von feinverteilten Luftblasen die Ausdehnung der Grenzflächen im Medium stark erhöht, so lagern sich Tensidmoleküle an den Grenzflächen an, es bildet sich Schaum und die Anzahl an Mizellen verringert sich, bis letztlich bei Unterschreitung des CMC keine Mizellen mehr verbleiben.
Hinweise für verschiedene Systeme[Bearbeiten | Quelltext bearbeiten]
Die CMC ist als die kritische Konzentration im Innern der Flüssigkeit definiert, also ohne Berücksichtigung der Grenzflächen an der Oberfläche und an den Gefäßwänden. Für die meisten Systeme ist dieser Hinweis von keiner Relevanz, insbesondere wenn die Anzahl der Tensidmoleküle in der Flüssigkeit selbst (in der „Bulk-Phase“, also im „Bulk“ oder in der „Volumenphase“) gegenüber der Anzahl der Tensidmoleküle in der Oberfläche sehr groß ist. Somit kann für diese Fälle die Konzentration der Tenside leicht über die Menge der zugegebenen Tenside und Flüssigkeitsvolumen (oder Masse) bestimmt werden.
In einigen Sonderfällen, beispielsweise wenn die freie Oberfläche im Vergleich zum Flüssigkeitsvolumen durch Luftblasen groß ist, kann die Tensidkonzentration in der Flüssigkeit jedoch nicht mehr über die beschriebene Methode bestimmt werden. So binden sich z. B. in Blasensäulen große Mengen der Tenside an die aufsteigenden Blasen, so dass die lokale Konzentration in der Flüssigkeit unter die CMC fallen kann. Diese Methode kann auch benutzt werden, um Tenside aus einer Lösung zu entfernen (Flotation). Ähnliche Überlegungen lassen sich für Emulsionen und Suspensionen durchführen.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Grenzflächenchemie Institut für Physikalische und Theoretische Chemie, TU Braunschweig
- Theorie auf der Website von Krüss
Literatur[Bearbeiten | Quelltext bearbeiten]
- S. A. Baeurle, J. Kroener: Modeling effective interactions of micellar aggregates of ionic surfactants with the Gauss-Core potential. In: J Math Chem. 36, 2004, S. 409–421.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Compendium of Chemical Terminology IUPAC
- ↑ Grenzflächenchemie PCI, TU Braunschweig
- ↑ J. A. Reynolds, Charles Tanford: Binding of dodecyl sulfate to proteins at high binding ratios. Possible implications for the state of proteins in biological membranes. In: Proceedings of the National Academy of Sciences. Band 66, Nummer 3, Juli 1970, S. 1002–1007, PMID 5269225, PMC 283150 (freier Volltext).