Methylammoniumchlorid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
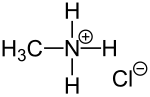
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Methylammoniumchlorid | |||||||||||||||
| Andere Namen |
Methylaminhydrochlorid | |||||||||||||||
| Summenformel | CH6ClN | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff mit ammoniakartigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 67,52 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
225–230 °C (20 hPa)[2] | |||||||||||||||
| Löslichkeit |
sehr leicht in Wasser (1080 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Methylammoniumchlorid (auch: Methylaminhydrochlorid) ist eine organische chemische Verbindung,die zwei Stoffgruppen angehört. Als Ammoniumverbindung gehört die Verbindung zur Stoffgruppe der einfach alkylierten Ammoniumverbindungen. Als Hydrochlorid ist die Verbindung ein Salz aus der Gruppe der organischen Hydrochloride. Als festes Salz des bei Raumtemperatur gasförmigen Amins Methylamin ist die Verbindung wesentlich leichter zu handhaben und zu transportieren als das gasförmige Amin selbst, das auch ein Gefahrstoff ist.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Neutralisiert man das basische Methylamin mit Salzsäure und verdampft das Wasser, dann erhält man als Rückstand das Salz Methylammoniumchlorid, das Hydrochlorid des Methylamins.[3]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Methylammoniumchlorid ist ein brennbarer, schwer entzündbarer, hygroskopischer, kristalliner, weißer Feststoff mit ammoniakartigem Geruch, der sehr leicht löslich in Wasser ist. Er zersetzt sich bei Erhitzung.[1]
Verwendung[Bearbeiten | Quelltext bearbeiten]
In einer alkalischen Lösung entsteht Methylamin direkt aus Methylammoniumchlorid.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g Eintrag zu Methylammoniumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Datenblatt Methylammoniumchlorid bei Merck, abgerufen am 27. April 2018.
- ↑ Sabine Cécile Zeeck, Stephanie Grond, Ina Papastavrou: Chemie für Mediziner. Elsevier Health Sciences, 2017, ISBN 978-3-437-18015-6, S. 257 (eingeschränkte Vorschau in der Google-Buchsuche).


