Fluormethan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Fluormethan | |||||||||||||||
| Andere Namen | ||||||||||||||||
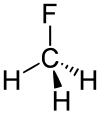
| Summenformel | CH3F | |||||||||||||||
| Kurzbeschreibung |
leicht entzündliches farbloses Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 34,03 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−78,4 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
gut in Wasser (2,3 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Dipolmoment | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Treibhauspotential |
141 (bezogen auf 100 Jahre)[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Fluormethan ist eine bei Raumtemperatur gasförmige, leicht entzündliche chemische Verbindung aus der Gruppe der Fluorkohlenwasserstoffe.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Das Fluormethanmolekül ist aufgrund der hohen Elektronegativität des Fluor stark polar, was zu einer Löslichkeit von 2,3 g·l−1 Wasser (bei 20 °C) führt.[2] Fluormethan hat eine kritische Temperatur von 44,55 °C, der kritische Druck liegt bei 58,742 bar und die kritische Dichte bei 0,30 kg/l. Die Tripelpunkt-Temperatur liegt bei −137,8 °C, was der Schmelztemperatur entspricht. Seine spezifische Wärmekapazität bei 25 °C beträgt Cp = 38,171 Jmol−1K−1.[1] Die Verbindung hat ein Treibhauspotenzial von 141.
Verwendung[Bearbeiten | Quelltext bearbeiten]
Fluormethan wird in der Produktion von Halbleitern als Ätzgas und beim Plasmaätzen verwendet.[2] Es wurde auch als Kältemittel eingesetzt.
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Fluormethan bildet mit Luft ein explosionsfähiges Gemisch. Durch den fehlenden Geruch ist eine Belastung in der Luft nicht wahrnehmbar. Toxische Auswirkungen auf Organismen sind nicht bekannt.[5] Bei der Verbrennung kann hochgiftiger Fluorwasserstoff entstehen. Wie bei anderen Fluor- und Fluorchlorkohlenwasserstoffen wird eine narkotische Wirkung vermutet.[1]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i j k Eintrag zu Fluormethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Februar 2017. (JavaScript erforderlich)
- ↑ a b c Produktdatenblatt Fluormethan bei AirLiquide, abgerufen am 9. Februar 2017.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- ↑ G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (englisch, ipcc.ch [PDF]).
- ↑ Sicherheitsdatenblatt Fluormethan (PDF; 38 kB). Air Liquide, abgerufen am 15. Juli 2017.

