Selexipag
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
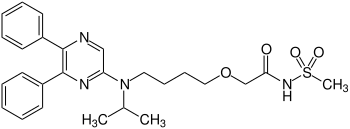
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Selexipag | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C26H32N4O4S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| Wirkmechanismus |
selektiver Prostacyclin (IP)-Rezeptor-Agonist | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 496,6 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Selexipag ist ein Arzneistoff zur Behandlung eines Bluthochdrucks im Blutkreislauf der Lungen (der pulmonalen arteriellen Hypertonie). Es ist ein oraler selektiver Agonist des Prostacyclin (IP)-Rezeptors und führt darüber zu einer Vasodilatation besonders im Lungenkreislauf, was dort zu einer Blutdrucksenkung führt.[2]
Der Arzneistoff ist selbst am IP-Rezeptor aktiv und hat außerdem einen aktiven Metaboliten mit längerer Halbwertszeit, ACT-333679 (MRE-269), welcher die freie Carbonsäure darstellt.[2]

Selexipag wurde von dem Schweizer Pharmaunternehmen Actelion entwickelt und erhielt unter dem Handelsnamen Uptravi im Dezember 2015 durch die US-amerikanische Arzneimittelbehörde FDA die Zulassung als Orphan-Arzneimittel zur Behandlung der pulmonalen arteriellen Hypertonie.[3] Im Mai 2016 folgte die Zulassung in der EU.
Phase-III-Studie[Bearbeiten | Quelltext bearbeiten]
Die Zulassung erfolgte vor allem aufgrund der Ergebnisse der „GRIPHON“-Studie, einer französischen multizentrischen randomisierten doppelblinden Placebo-kontrollierten klinischen Phase-III-Studie. Hierbei wurden 1.156 Patienten mit idiopathischer, hereditärer oder sekundärer pulmonaler arterieller Hypertonie eingeschlossen, die individualisiert bis zu 1.600 μg Selexipag (oder Placebo) bis zweimal täglich für im Median 70 Wochen (Placebo im Median 63 Wochen) erhielten. Dabei zeigte sich ein signifikanter positiver Effekt mit einer Hazard ratio von 0,60 unter Selexipag (Konfidenzintervall 0,46–0,78). Der primäre Endpunkt wurde als Tod oder Komplikation durch die pulmonale arterielle Hypertonie definiert und in 27,0 % unter Selexipag bzw. in 41,6 % unter Placebo erreicht. Schwere unerwünschte Wirkungen traten signifikant häufiger auf und führten in 14,3 % zum vorzeitigen Therapieabbruch (unter Placebo in 7,1 %). Besonders oft traten Kopfschmerzen (65 % unter Selexipag versus 33 % unter Placebo), Durchfall (42 % vs. 19 %), Übelkeit (34 % vs. 19 %), Kieferschmerzen (26 % vs. 6 %) und Erbrechen (18 % vs. 9 %) auf.[4]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Selexipag
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Olivier Sitbon, Nicholas W. Morrell: Pathways in pulmonary arterial hypertension: The future is here. European Respiratory Review 2012, Band 21, Ausgabe 126, Seiten 321–327; doi:10.1183/09059180.00004812.
- ↑ New Drug Approved for Rare Lung Disorder. PPN. 23. Dezember 2015.
- ↑ Olivier Sitbon, Richard Channick et al.: Selexipag for the treatment of pulmonary arterial hypertension. New England Journal of Medicine 2015, Band 373, Ausgabe 26 vom 24. Dezember 2015, Seiten 2522–2533, DOI:10.1056/NEJMoa1503184.