Tetrahydroxyspirobisindan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
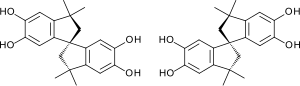
| |||||||||||||||||||
| Strukturformeln beider Enantiomere | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tetrahydroxyspirobisindan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C21H24O4 | ||||||||||||||||||
| Kurzbeschreibung |
beiger bis hellbrauner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 340,41 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Tetrahydroxyspirobisindan ist eine chemische Verbindung uns der Gruppe der polycyclischen aromatischen Spiroverbindungen.
Isomerie[Bearbeiten | Quelltext bearbeiten]
Die Struktur von Tetrahydroxyspirobisindan ist durch die sp3-Hybridisierung des Spirokohlenstoffs starr und annähernd rechtwinklig aufgebaut.[3] Die Verbindung ist chiral und liegt synthesebedingt in der Regel als Racemat (1:1-Gemisch) von zwei Enantiomeren vor.
Die beiden Enantiomere sind durch Racematspaltung einfach zugänglich.
Weitere Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Der Drehwert der beiden Enantiomere beträgt +44° bzw. −44° bei 26 °C und 589 nm (c = 1 in Methanol). Racemisierung kann nur durch Zerstörung der Struktur erfolgen. Tetrahydroxyspirobisindan neigt unter Licht- und Sauerstoffkontakt zur raschen Oxidation bis zum dunkelorange gefärbten Tetraoxolen.[4]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Tetrahydroxyspirobisindan wird durch Kondensation von Aceton mit Brenzcatechin in mäßigen Ausbeuten dargestellt, katalysiert durch wässrige konzentrierte Halogenwasserstofflösungen.[5] Mechanistisch wird zunächst die Aldolreaktion dreier Acetonmoleküle postuliert, welche abschließend in einer Friedel-Crafts-Alkylierung an die Brenzcatechine substituiert werden.
Verwendung[Bearbeiten | Quelltext bearbeiten]
- Durch Substitution mit 1,2,4,5-Tetrafluoro-substituierten Aromaten als Comonomer lassen sich lineare und cyclische Polymere herstellen. Diese zeichnen sich durch einen starren Molekülbau aus. Die schwammartigen rigiden Polymere werden als Polymers of Intrinsic Microporosity (PIM) bezeichnet und eignen sich unter anderem zur Filtration und Trennung von Gasgemischen[6]
- Es wird die Anwendung von enantiomerenreinen Derivaten des Tetrahydroxyspirobisindan zur Anwendung in Flüssigkristall-Displays als chiraler Dotierungsstoff beschrieben[7]
- Die Anwendung von Tetrahydroxyspirobisindanderivaten als UV-Stabilisator in photographischen Schichten ist beschrieben[8]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Stoffdatenblatt 5,5',6,6'-Tetrahydroxy-3,3,3',3'-tetramethyl-1,1'-spirobisindan, Organica Feinchemie GmbH Wolfen, abgerufen am 25. Mai 2012.
- ↑ a b c Datenblatt Tetrahydroxyspirobisindan bei Alfa Aesar, abgerufen am 18. Mai 2012 (Seite nicht mehr abrufbar).
- ↑ J. Bjork, M. Brostrom, D. Whitcomb, Molecular and supramolecular structure of 5,5',6,6'-tetrahydroxy-3,3,3',3'-tetramethyl-1,1'-spirobisindane, tetrahydrofuran solvate, in: Journal of Chemical Crystallography, 1997, 27, 223–230; doi:10.1007/BF02575959.
- ↑ A. Dei, L. Sorace, pH-Triggered intramolecular electron transfer in asymmetric bis-dioxolene adducts , in: Dalton Transactions, 2003, 17, 3382–3386; doi:10.1039/B307270C.
- ↑ W. Baker, The condensation of catechol with acetone, in: Journal of the Chemical Society (Resumed), 1934, 1678-1681; doi:10.1039/JR9340001678.
- ↑ M. Carta u. Mitarb., Novel Spirobisindanes for Use as Precursors to Polymers of Intrinsic Microporosity, in: Organic Letters, 2008, 10, 2641-2643; doi:10.1021/ol800573m.
- ↑ Patent EP1768943: Process for preparing enantiomerically pure 1,1'-spirobiindane-6,6'-diol derivatives. Angemeldet am 7. Juli 2005, veröffentlicht am 4. April 2007, Anmelder: Industrial Technology Research Institute, Erfinder: Thomas Robert Welter.
- ↑ Patent US4360589: Color photographic light-sensitive materials. Angemeldet am 14. Mai 1981, veröffentlicht am 23. November 1982, Anmelder: Fuji Photo Film Co., Ltd., Erfinder: Tetsuro Kojima, Masakazu Morigaki, Tsutomu Hamaoka, Satoru Sawada.
