Uran(IV)-sulfat
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
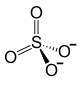
| ||||||||||
| Allgemeines | ||||||||||
| Name | Uran(IV)-sulfat | |||||||||
| Summenformel | U(SO4)2 | |||||||||
| Kurzbeschreibung |
grüner Feststoff (Octahydrat)[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 502,22 g·mol−1 (Tetrahydrat) | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Dichte |
3,6 g·cm−3 (Tetrahydrat)[1] | |||||||||
| Gefahren- und Sicherheitshinweise | ||||||||||
 Radioaktiv | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Uran(IV)-sulfat ist eine chemische Verbindung des Urans aus der Gruppe der Sulfate. Neben dieser ist mit Uran(III)-sulfat ein weiteres Sulfat des Urans bekannt.
Darstellung[Bearbeiten | Quelltext bearbeiten]
Uran(IV)-sulfat-Octahydrat kann durch kathodische Reduktion von Uranylsulfat UO2SO4 gewonnen werden.[1]
Das Tetrahydrat kann durch Zugabe von Schwefelsäure zur Lösung des Octahydrates gewonnen werden.[1]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Uran(IV)-sulfat-octahydrat ist ein dunkelgrüner Feststoff mit monoklinen prismatischen Kristallen, bei deren Lösen in Wasser Hydrolyse unter Abscheidung des basischen Sulfats UOSO4·2H2O erfolgt. Das Tetrahydrat kommt als weißlich-grüner Niederschlag aus sternförmig angeordneten Kristallen mit orthorhombischer Kristallstruktur vor.[1]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Radiumextraktion[Bearbeiten | Quelltext bearbeiten]
Die Löslichkeit von Uransulfat in Wasser war historisch bedeutend bei der Gewinnung des (nicht wasserlöslichen) Radiumsulfat, wobei dieses aufgrund der geringen Konzentration mittels Bariumsulfat ausgesalzen werden musste, bevor durch fraktionierte Kristallisation das gewünschte Radium vom Trägermaterial abgeschieden werden konnte. Radium war einige Jahrzehnte lang das teuerste verfügbare chemische Element, da es nur mit rund 300 Milligramm pro Tonne Uran in Uranerzen verfügbar war. Anwendungen von Radium, welche sich von der Radioaktivität (reale oder wissenschaftlich nicht haltbare) positive Effekte erhofften, wurden inzwischen fast sämtlich durch künstlich erzeugte Radionuklide ersetzt oder gänzlich aufgegeben, sodass Radium heute kaum noch gewonnen wird.
Uranbergbau[Bearbeiten | Quelltext bearbeiten]
Im modernen Lösungsbergbau ist Uran(IV)-sulfat eine mögliche Form, Uran durch so genanntes in-situ leaching zu gewinnen, jedoch operiert dieses Verfahren üblicherweise mittels Natriumdiuranat im basischen Milieu, anstatt mittels Schwefelsäure im sauren Milieu zu arbeiten.
Kernreaktoren[Bearbeiten | Quelltext bearbeiten]
Der Aqueous homogeneous reactor, ein Versuchsprojekt, welches klassische Brennelemente durch eine Uran(IV)-sulfat-Lösung ersetzte, wurde nie großtechnisch eingesetzt. Die Vorteile, welche man sich von einem im Normalbetrieb flüssigen Reaktorkern erhofft(e), werden inzwischen im Zuge der Forschung am Flüssigsalzreaktor verfolgt, welcher aufgrund höherer erzielbarer Betriebstemperatur einen besseren Carnot-Wirkungsgrad erreicht.
Umweltprobleme[Bearbeiten | Quelltext bearbeiten]
Saure Grubenwässer[Bearbeiten | Quelltext bearbeiten]
Saure Grubenwässer entstehen, wenn schwefelhaltige Mineralien zu Schwefelsäure oxidieren. Wie einige andere Schwermetalle, die im neutralen Milieu nicht wasserlösliche Verbindungen bilden, kann auch Uran in sauren Grubenwässern als Uran(IV)Sulfat in Lösung gehen und entsprechende Belastungen der Gewässer und des Grundwassers verursachen. Zur Bekämpfung dieses Phänomens wird das Wasser „gekalkt“, also Calciumcarbonat oder Calciumoxid hinzugegeben, um die Schwefelsäure zu neutralisieren und Sulfat-Ionen als Calciumsulfat ausfallen zu lassen.
Phosphatdünger[Bearbeiten | Quelltext bearbeiten]
Bei der Gewinnung von Phosphat aus Apatit oder Fluorapatit wird üblicherweise ebenfalls mit Schwefelsäure gearbeitet, sodass natürlicherweise im Erz vorhandenes Uran als Verunreinigung in die flüssige Phase mit der Phosphorsäure übergeht. Deswegen können mineralische Phosphordünger messbare Mengen Uran enthalten und auf lange Sicht zu einer Anreicherung desselben im Boden führen. Der ebenfalls anfallende Phosphorgips enthält üblicherweise die nicht löslichen Sulfate, neben dem Hauptbestandteil Calciumsulfat unter Umständen auch Radiumsulfat. Daher ist seine Verwendung in vielen Ländern verboten und er muss deponiert werden, wobei die Deponien neben ihrem Raumbedarf eine Gefahr durch Staub- oder Wasseraustrag darstellen können.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Georg Brauer (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearb. Auflage. Band II. Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1245.
- ↑ Eintrag zu Uranverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag uranium compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung.

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)



