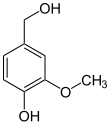
Vanillylalkohol-Oxidase
| Vanillylalkohol-Oxidase (Penicillium simplicissimum) | ||
|---|---|---|
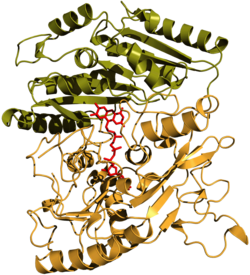
| ||
| Bändermodell nach PDB 1VAO; FAD-Molekül (rot), Cap-Domäne (grün), FAD-Bindedomäne (orange) | ||
|
Vorhandene Strukturdaten: 1ahu, 1ahv, 1ahz, 1dzn, 1e0y, 1e8f, 1e8g, 1e8h, 1qlt, 1qlu, 1w1j, 1w1k, 1w1l, 1w1m, 2vao | ||
| Masse/Länge Primärstruktur | 560 Aminosäuren; 64 kDa (jeweils Monomer) | |
| Sekundär- bis Quartärstruktur | Homooctamer | |
| Kofaktor | FAD | |
| Bezeichner | ||
| Gen-Name(n) | VAOA | |
| Externe IDs |
| |
| Enzymklassifikation | ||
| EC, Kategorie | 1.1.3.38, Oxidoreduktase | |
| Substrat | siehe Text, O2 | |
| Produkte | siehe Text, H2O2 | |
| Vorkommen | ||
| Übergeordnetes Taxon | Bakterien, Pilze[1] | |
Vanillylalkohol-Oxidase (VAO, EC 1.1.3.38) ist ein Enzym in Bakterien und Pilzen, das die Oxidation verschiedener phenolischer Verbindungen unter Verbrauch von Sauerstoff (O2) katalysiert. Dabei entsteht Wasserstoffperoxid (H2O2). Für die Reaktion wird als Kofaktor ein Flavinmolekül, FAD, benötigt. VAOs sind in den Peroxisomen lokalisiert und gehören zu einer speziellen Art von Arylalkohol-Oxidasen an, sie sind für die Ligninverwertung durch Mikroorganismen von Bedeutung.
1992 wurde erstmals die Vanillylalkohol-Oxidase aus dem Schlauchpilz Penicillium simplicissimum isoliert und charakterisiert und 1997 dessen Struktur geklärt.[2][3] VAO wird in diesem Pilz stark exprimiert, wenn dieser auf Veratrylalkohol, Anisalkohol oder 4-(Methoxymethyl)phenol wächst.[4]
Der Artikel bezieht größtenteils Daten über das Enzym aus P. simplicissimum.
Klassifizierung[Bearbeiten | Quelltext bearbeiten]
Die intrazelluläre Vanillylalkohol-Oxidase gehört zu den Arylalkohol-Oxidasen. Diese zählen wiederum zur weit verbreiteten Gruppe der Oxidoreduktasen, die alle eine konservierte FAD-Bindedomäne aufweisen. Durch Aminosäuresequenzvergleiche geht hervor, dass die Vanillylalkohol-Oxidase eine eigenständige Klasse bildet, die der VAO-Flavoproteinfamilie.[5][6] Zu dieser Familie zählen beispielsweise die Eugenol-Oxidase, Chloesteroloxidase (EC 1.1.3.6) und die Alditol-Oxidase.
Katalysierte Reaktion[Bearbeiten | Quelltext bearbeiten]
VAO katalysiert die Oxidation verschiedener phenolischer Verbindungen, vor allem zahlreiche 4-Alkylphenole.[3] Ursprünglich wurde in-vitro die Oxidation von Vanillylalkohol zu Vanillin nachgewiesen:
Die physiologische Bedeutung dieser Reaktion ist nicht ganz bekannt. So ist Vanillylalkohol nicht ein Intermediat bei dem Abbau von Veratrylalkohol, das die Produktion von VAO in P. simplicissimum induziert.
Ferner kann VAO auch oxidativ p-Methoxykresol (4-(Methoxymethyl)phenol) zu 4-Hydroxybenzaldehyd demethylieren. Dabei entsteht Methanol. In der Reaktion dient Wasser als nukleophiles Agenz und bildet die Aldehydgruppe im neu entstandenen 4-Hydroxybenzaldehyd. Während der Katalyse wird FAD zunächst reduziert, und anschließend durch molekularen Sauerstoff reoxidiert. Dabei entsteht Wasserstoffperoxid. p-Methoxykresol ist ein physiologisches Substrat.[7]
Auch eine Desaminierung von Vanillylamin zu Vanillin wurde nachgewiesen. Die Umsetzung von Eugenol zu Coniferylalkohol wird ebenfalls von VAO katalysiert, was allgemein eine oxidative Hydration von 4-Allylphenolen darstellt. Hierbei zeigt sich die höchste enzymatische Aktivität: Eugenol und Chavicol sind die besten Substrate für VAO.
VAO aus P. simplicissimum zeigt – in vitro – ein pH-Optimum zwischen 9 und 10,5 und ein Temperaturoptimum bei 38 °C.[2]
Struktur[Bearbeiten | Quelltext bearbeiten]
Die VAO aus P. simplicissimum ist ein Oktamer gleicher Untereinheiten. Hierbei bilden Tetramere von Dimeren die Gesamtstruktur. Das Oktamer ist ca. 500 kDa schwer. In Anwesenheit von chaotropen Agenzien zerfällt das Oktamer in Dimere. Die Dimere zeigen auch eine katalytische Aktivität. Das Monomer ist 560 Aminosäuren bzw. 64 kDa groß und besteht aus zwei Domänen, einer FAD-Bindedomäne und einer Cap-Domäne. Letztere ist für die Substratbindung nötig.[5] Jedes Monomer trägt als Cofaktor ein gebundenes Flavinmolekül. Dieses ist über den Isoalloxazinring an ein L-Histidin (His422) kovalent verknüpft.
Katalytisches Zentrum[Bearbeiten | Quelltext bearbeiten]
Das katalytische Zentrum des Enzyms bildet eine wasserunzugängliche Höhle mit ca. 200 Å3 Volumen. Es ist von hydrophoben und aromatischen Aminosäuren umgeben.
FAD[Bearbeiten | Quelltext bearbeiten]

VAO ist das erste Enzym bekannter Struktur, bei dem das C8-Kohlenstoffatom eines Flavinmoleküls an einem Nε2-Atom von Histidin-422 kovalent verknüpft ist (siehe Abbildung). Die Planarität des Isoalloxazinringes wird dadurch nicht verändert. Der Isoalloxazinring bildet zudem mehrere Wasserstoffbrückenbindungen zum Apoprotein.
Die prosthetische Gruppe ist für die Enzymaktivität wichtig. Man geht davon aus, dass die kovalente Bindung an das Protein das Redoxpotential des Cofaktors für die Katalyse signifikant erhöht.[7] Hieran ist auch eine Aminosäure des Proteins, L-Aspartat-170, beteiligt. Wahrscheinlich wird FAD an das Apoprotein in einem autokatalytischen Prozess posttranslational verknüpft.[8]
Inhibitoren[Bearbeiten | Quelltext bearbeiten]
Für VAO wurde eine Reihe von Inhibitoren identifiziert. Isoeugenol, 2-Nitro-p-kresol, p-Kresol, Coniferylalkohol (Produkt bei der Umsetzung mit Eugenol) und Zimtalkohol inhibieren das Enzym in kompetitiver Weise.
Bedeutung[Bearbeiten | Quelltext bearbeiten]
Die Demethylierung von 4-(Methoxymethyl)phenol ist bei dem Schlauchpilz von physiologischer Bedeutung, da VAO den Abbauweg dieser Verbindung einleitet. Derivate dieser Verbindung sind durchaus Abbauprodukte von Lignin. Infolgedessen kann VAO zur Metabolisierung dieser Substrate dienen und beim Ligninabbau eine Rolle spielen.[4]
Das Enzym katalysiert (in vitro) die Produktbildung von zwei Monolignolen, Coniferylalkohol und Cumarylalkohol.[9] Monolignole werden hauptsächlich von Pflanzen im Zuge der Ligninbildung generiert. Das dritte Monolignol, Sinapylalkohol, kann jedoch nicht durch VAO erzeugt werden.
Im Gegensatz zu den extrazellulären Arylalkohol-Oxidasen vieler Ständerpilze ist die Substratspezifität der VAO viel enger. Durch sein Katalysenspektrum könnte das Enzym für die chemische Industrie als Biokatalysator Einzug finden.[10]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Robert H. H. van den Heuvel, Marco W. Fraaije, Colja Laane, Willem J. H. van Berkel: Enzymatic Synthesis of Vanillin. In: Journal of Agricultural and Food Chemistry. 49, 2001, S. 2954–2958. doi:10.1021/jf010093j.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Interpro-Eintrag
- ↑ a b E. de Jong, W. J. van Berkel, R. P. van der Zwan, J. A. de Bont: Purification and characterization of vanillyl-alcohol oxidase from Penicillium simplicissimum. A novel aromatic alcohol oxidase containing covalently bound FAD. In: Eur J Biochem. 208 (3), 1992, S. 651–657. PMID 1396672.
- ↑ a b A. Mattevi, M. W. Fraaije, A. Mozzarelli, L. Olivi, A. Coda, W. J. van Berkel: Crystal structures and inhibitor binding in the octameric flavoenzyme vanillyl-alcohol oxidase: the shape of the active-site cavity controls substrate specificity. In: Structure. 5 (7), 1997, S. 907–920. PMID 9261083; doi:10.1016/S0969-2126(97)00245-1 (freier Volltext).
- ↑ a b M. W. Fraaije, M. Pikkemaat, W. J. van Berkel: Enigmatic Gratuitous Induction of the Covalent Flavoprotein Vanillyl-Alcohol Oxidase in Penicillium simplicissimum. In: Appl Environ Microbiol. 63 (2), 1997, S. 435–439. PMID 16535508. PDF (freier Volltextzugriff, engl.)
- ↑ a b M. W. Fraaije, W. J. van Berkel, J. A. Benen, J. Visser, A. Mattevi: A novel oxidoreductase family sharing a conserved FAD-binding domain. In: Trends Biochem Sci. 23 (6), 1998, S. 206–207. PMID 9644973.
- ↑ N. G. Leferink, D. P. Heuts, M. W. Fraaije, W. J. van Berkel: The growing VAO flavoprotein family. In: Arch Biochem Biophys. 474 (2), 2008, S. 292–301. PMID 18280246. doi:10.1016/j.abb.2008.01.027
- ↑ a b R. H. van den Heuvel, M. W. Fraaije, A. Mattevi, W. J. van Berkel: Asp-170 is crucial for the redox properties of vanillyl-alcohol oxidase. In: J Biol Chem. 275 (20), 2000, S. 14799–14808. PMID 10809721. PDF (freier Volltextzugriff, engl.)
- ↑ J. Jin, H. Mazon, R. H. van den Heuvel, A. J. Heck, D. B. Janssen, M. W. Fraaije: Covalent flavinylation of vanillyl-alcohol oxidase is an autocatalytic process. In: FEBS J 275 (20), 2008, S. 5191–5200. PMID 18793324.
- ↑ M. W. Fraaije, C. Veeger, W. J. van Berkel: Substrate specificity of flavin-dependent vanillyl-alcohol oxidase from Penicillium simplicissimum. Evidence for the production of 4-hydroxycinnamyl alcohols from 4-allylphenols. In: Eur J Biochem. 234 (1), 1995, S. 271–277. PMID 8529652.
- ↑ M. W. Fraaije, W. J. van Berkel: Catalytic mechanism of the oxidative demethylation of 4-(methoxymethyl)phenol by vanillyl-alcohol oxidase. Evidence for formation of a p-quinone methide intermediate. In: J Biol Chem. 272(29), 1997, S. 18111–18116. PMID 9218444; PDF (freier Volltextzugriff, engl.)