Viminol
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
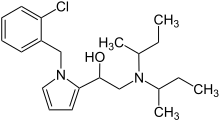
| ||||||||||||||||||||||
| Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Viminol | |||||||||||||||||||||
| Andere Namen |
1-{1-[(2-Chlorphenyl)methyl]pyrrol-2-yl}-2-[di(butan-2-yl)amino]ethanol | |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Viminol ist ein peroral wirksames Analgetikum mit zentralem Angriffspunkt, in der Wirkungsstärke mit Codein vergleichbar. Es wird zur Behandlung akuter und chronischer Schmerzzustände angewandt.[1] Die Verbindung gehört zur Wirkstoffgruppe der Opioide.[5]
Herstellung[Bearbeiten | Quelltext bearbeiten]
Eine dreistufige Synthese von Viminol startet mit einer Friedel-Crafts-Acylierung von 1-(2-Chlorbenzyl)-1H-pyrrol[6] mit Oxalylchlorid. Das resultierende Säurechlorid wird mittels Di-(1-methylpropyl)amin in das entsprechende Säureamid überführt. Im letzten Schritt ergibt eine Reduktion mit Natrium-bis(2-methoxyethoxyethyl)aluminiumdihydrid die Zielverbindung.[4][7]
Bei der Synthese fällt ein komplexes Gemisch der Diastereoisomeren an, das als Arzneistoff eingesetzt wird.
Herstellung reiner Stereoisomerer[Bearbeiten | Quelltext bearbeiten]
Die Herstellung der reinen Stereoisomeren besitzt keine praktische Bedeutung. Es erfordert den Einsatz der entsprechenden Stereoisomeren des Edukts Di-(1-methylpropyl)amin im zweiten Syntheseschritt und eine Enantiomerentrennung der sekundären Alkoholstruktur nach dem dritten Schritt.[8][9]
Stereochemie[Bearbeiten | Quelltext bearbeiten]
Die Struktur von Viminol zeigt drei chirale Zentren, so dass eine Reihe von Stereoisomeren existieren. Die Stereoisomeren wurden gezielt hergestellt und hinsichtlich ihren pharmakologischen Eigenschaften charakterisiert. Hier zeigte das R2–Isomer eine besonders hohe Wirksamkeit mit einer Effektivdosis ED50 von 0,9 mg·kg−1 gegenüber von etwa 20 mg·kg−1 für die anderen Stereoisomeren.[8][9][10][11]
| Stereoisomere von Viminol[8][9] | ||||||||||||

| ||||||||||||
| Stereozentrum | ||||||||||||
| Isomer | 1 | 2 | 3 | |||||||||
| R1 | R | R | R | |||||||||
| R2 | R | R | S | |||||||||
| S1 | S | S | R | |||||||||
| S2 | S | S | S | |||||||||
| meso | RS | RS | RS | |||||||||
Anwendungsgebiete und Wirkungen[Bearbeiten | Quelltext bearbeiten]
Viminol ist angezeigt zur Behandlung verschiedener (osteoarthritische, neuropathische, viszerale, vaskuläre, neoplastische) Schmerzen; auch Kopfschmerzen, Zahnschmerzen, postoperative Schmerzen.[12]
Als unerwünschte Wirkung kann Viminol in einigen Fällen eine leicht sedierende Wirkung mit Schwindel und Benommenheit zeigen. Gelegentlich treten Völlegefühl oder Übelkeit auf. Die längere Einnahme hoher Dosen kann zu Abhängigkeit, Toleranz und Entzugssyndrom führen.[12]
Das 1974 in Italien[13] unter dem Namen Dividol[12] und 1978 in der BRD[13] als Lenigesial[14] von der Zambon Gruppe eingeführte Präparat enthält bzw. enthielt den Wirkstoff als Viminol(4-hydroxybenzoat).[15]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Siegfried Ebel und Hermann J. Roth (Hrsg.): Lexikon der Pharmazie, Georg Thieme Verlag, 1987, S. 678, ISBN 3-13-672201-9.
- ↑ The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; S. 1716, ISBN 978-0-911910-00-1.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances - Synthesis, Patents, Applications, 4. Auflage (2001) Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9.
- ↑ Eintrag zu Opioide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2022.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1-(2-Chlorbenzyl)-1H-pyrrol: CAS-Nummer: 23694-46-4, EG-Nummer: 245-830-6, ECHA-InfoCard: 100.041.649, PubChem: 90240, ChemSpider: 81466, Wikidata: Q82924096.
- ↑ Patent BE 790 747 (Whitefin Holding; appl. 30.10.1972; I-prior. 4.7.1972; 30.10.1971).
- ↑ a b c Casy, A.F.: Analgesics and their antagonists: Recent developments in Progress in Drug Research/Fortschritte der Arzneimittelforschung/Progres des recherches pharmaceutiques Vol. 22, Ed. Jucker, E., Birkhauser Verlag Basel und Stuttgart 1978, ISBN 978-3-0348-7104-4, doi:10.1007/978-3-0348-7102-0, S. 149–228.
- ↑ a b c Casy, A.F.; Dewar, G.H.: The Steric Factor in Medicinal Chemistry – Dissymmetric Probes of Pharmacological Receptors, Springer Science+Business Media, LLC 1993, ISBN 978-1-4899-2399-8, doi:10.1007/978-1-4899-2397-4, S. 543–544.
- ↑ Bella, D.D.; Benelli, G.; Sassi, A.: Absolute configuration and biological activity of viminol stereoisomers in Pharmacol. Res. Commun. 8 (1976) 111–126, doi:10.1016/0031-6989(76)90001-1.
- ↑ Chiarino, D.; Bella, D.D.; Jommi, G.; Veneziani, C.: Stereochemistry of viminol, a novel central analgesic in Arzneimittelforschung/Drug Research 28 (1978) 1554–1561.
- ↑ a b c Dividol 50 mg Capsule rigide, Riassunto delle caratteristiche del prodotto (Zusammenfassung der Merkmale des Arzneimittels), Zambon Italia s.r.l., Stand: Juni 2010.
- ↑ a b Pharmaceutical Manufacturing Encyclopedia, 3rd Ed., William Andrew Publishing, New York, 2007, S. 3429.
- ↑ AMIce Datenbank den Bundes und der Länder, abgerufen am 2. Januar 2022.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Viminol(4-hydroxybenzoat): CAS-Nummer: 23784-10-3, EG-Nummer: 682-836-1, ECHA-InfoCard: 100.208.356, PubChem: 211972, ChemSpider: 183782, Wikidata: Q27265665.
