Zinkhydroxid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| _ Zn2+ _ O− _ H+ | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Zinkhydroxid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Verhältnisformel | Zn(OH)2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses, geruchloses Pulver[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 99,41 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
3,11 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Zinkhydroxid ist eine chemische Verbindung aus der Gruppe der Hydroxide mit der Formel Zn(OH)2. Es ist ein unbrennbares, farbloses und geruchloses Pulver, welches in Wasser schwer löslich ist.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Zinkhydroxid kommt natürlich in drei seltenen Mineralien vor. Wülfingit (orthorhombisch), Ashoverit und Sweetit (beide tetragonal). Es entsteht weiterhin bei der Entladung in Alkali-Mangan-Batterien und ist einer der Hauptbestandteile von Weißrost.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Zinkhydroxid kann durch Reaktion von Zink(II)-chlorid mit Natriumhydroxid gewonnen werden.[3]
Allgemein fällt Zinkhydroxid als gallertartige Masse aus Lösungen aus, die sowohl Zn2+ als auch (OH)−-Ionen enthalten. Dies wird zum Nachweis von Zink-Kationen verwendet.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
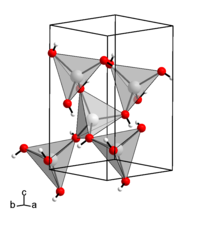
Zinkhydroxid ist (wie viele Metallhydroxide) schwer in Wasser löslich. Es ist ein amphoteres Hydroxid, also sowohl im sauren, als auch im alkalischen Medium löslich. In Säuren löst es sich unter Bildung von [Zn(H2O)6]2+-Ionen, in konzentrierten Basen unter Bildung von Hydroxozinkat-Ionen [Zn(OH)4]2−.[4] Es besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe P212121 (Raumgruppen-Nr. 19), a = 5,17 Å, b = 8,55 Å, c = 4,93 Å[3], wobei jedoch noch fünf andere kristalline Formen existieren, die jedoch instabil sind und unter Normbedingungen in Zinkhydroxid (genauer ε-Zinkhydroxid) übergehen.[5] Die bei der Auflösung von Zinkhydroxid theoretisch entstehenden Oxo- und Hydroxosäuren von Zink werden als Zinkate bezeichnet.
Verwendung[Bearbeiten | Quelltext bearbeiten]
Zinkhydroxid kann zur Herstellung von Zinkoxid verwendet werden.
Verwandte Verbindungen[Bearbeiten | Quelltext bearbeiten]
- Zinkhydroxidchlorid Zn(OH)Cl
- Zinkhydroxidphosphat Zn2(OH)PO4
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu ZINC HYDROXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c d e f Eintrag zu Zinkhydroxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1026.
- ↑ Erwin Riedel: Anorganische Chemie. 6. Auflage, ISBN 978-3-11-018168-5.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3.

