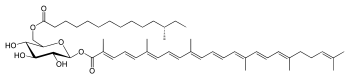
Staphyloxanthin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Staphyloxanthin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C51H78O8 | ||||||||||||
| Kurzbeschreibung |
goldgelber Farbstoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 819,2 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||

Staphyloxanthin ist ein orange- oder goldgelber Farbstoff in der Zellmembran des Bakteriums Staphylococcus aureus. Das Pigment gehört zu den Xanthophyllen (sauerstoffhaltige Carotinoide).
Das Carotinoidpigment wirkt als biologisches Antioxidans, indem es die von den Immunzellen des Wirts gebildeten reaktiven Sauerstoffverbindungen inaktiviert und dadurch die Mikroorganismen vor dem Abtöten durch die weißen Blutzellen schützt.[3]
Gerade bei den antibiotikaresistenten Superkeimen, den MRSA-Vertretern, deren Verbreitung in der Bevölkerung und in den Krankenhäusern seit 1990 rasant zugenommen hat, bildet Staphyloxanthin einen bedeutenden Virulenzfaktor. Zugleich schützt der Farbstoff die MRSA-Keime vor der Zerstörung durch Wasserstoffperoxid und Sauerstoffradikale.[4]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Staphyloxanthin wird in der Zellmembran des Bakteriums Staphylococcus aureus eingebaut und ist für dessen Färbung verantwortlich. Das Pigment ist gelb oder orange, in Abhängigkeit vom Sauerstoffangebot und den Nährstoffbedingungen. Die Farbe ist namensgebend für die Spezies (aureus, lateinisch für ‚golden‘). Neben dem Hauptpigment lassen sich verschiedenfarbige Zwischenprodukte des Biosynthesewegs isolieren.[5][6]
Aufbau und Funktion
[Bearbeiten | Quelltext bearbeiten]Strukturaufklärung
[Bearbeiten | Quelltext bearbeiten]Der Pigmentname, Staphyloxanthin, wurde erstmals[7] 1972 von John H. Marshall und E. S. Rodwell erwähnt.[8] 1981 isolierten und analysierten Marshall und Willmoth die chemischen Strukturen des Farbstoffs und weiterer Biosyntheseprodukte.[9] Das Hauptpigment wurde zunächst als ein α-D-Glucopyranosyl-1-O-(4,4ʹ-diaponeurosporen-4-oat)-6-O-(12-methyltetradecanoat) identifiziert, in dem Glucose mit einer Triterpenoid-Carotinoid-Carbonsäure und einer Fettsäure (C15) verestert ist.
2005 konnte mittels NMR-Spektroskopie die Struktur als eine β-D-Glucopyranosyl-1-O-(4,4ʹ-diaponeurosporen-4-oat)-6-O-(12-methyltetradecanoat)-Verbindung ermittelt werden. Von den in photosynthetisch und nicht photosynthetisch aktiven Bakterien und in Eukaryoten vorkommenden Carotinoiden mit 40 C-Atomen (C40), unterscheidet sich Staphyloxanthin durch die Veresterung von Glucose mit einer Triterpenoidsäure (C30) und einer Fettsäure (C15) sowie den Hydroxygruppen der Glucose.[1] Der Bakterienfarbstoff ist ein Vertreter der Triterpene, die zu den sekundären Inhaltsstoffen von Organismen gehören. Sie leiten sich formal vom Isopren ab. Staphyloxanthin ist ein fettlöslicher Farbstoff mit langkettigen Kohlenwasserstoffen, der zu den Carotinoiden gehört. Carotinoide kommen allgemein in vielen photosynthetischen und nicht photosynthetischen Organismen vor und haben in Bakterien und Hefen antioxidative Funktionen. Sie spielen eine Rolle bei der Lichtgewinnung, dem Energietransfer und der Regulierung der Membranfluidität.[10][11]
Physiologische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Durch zahlreiche konjugierte Doppelbindungen vermag Staphyloxanthin freie Energie von reaktiven Sauerstoffverbindungen zu absorbieren und unschädlich zu machen.[12][13][14] Als Radikalfänger kann das Carotinoid Singulettsauerstoff löschen und die Mikroben vor aggressiven Wasserstoffperoxid und Hydroxyl-Radikalen schützen. Diese Verbindungen sind vor allem bei der Immunreaktion im menschlichen Körper von Bedeutung. Hier werden in Phagosomen der Neutrophilen durch die NADPH-Oxidase reaktive Sauerstoffspezies zur Entfernung von Erregern gebildet. Staphylococcus-aureus-Bakterien können diesen mit Hilfe der antioxidativen Wirkung von Staphyloxanthin überleben.[15][16]
Als Membrancarotinoid beeinflusst der Farbstoff die Fluidität der Zellmembran und damit die Membranfestigkeit. Dies hat Auswirkungen auf die chemischen Eigenschaften und die funktionelle Aktivität der bakteriellen Zellmembran. Mit Staphyloxanthin pigmentierte Staphylokokken-Bakterien haben daher eine höhere Resistenz, da sie eine bessere Überlebenschance gegen antimikrobielle, von Zellen des Wirts gebildete Peptide und Proteasen haben. Damit weisen farbige Staphylokokken gegenüber weißen Vertretern eine höhere Vitalität auf. Zusätzlich schützt der Farbstoff die Mikroben vor der photooxidativen Zerstörung.[17][16]
Staphyloxanthin ähnelt somit in seiner physiologischen Bedeutung den Glycolipiden, obgleich es nicht zu diesen gezählt werden kann, weil die Säuren nicht glykosidisch an den Zucker gebunden sind.
Chemisch-physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Staphyloxanthin löst sich auf Grund seiner Moleküleigenschaften schlecht in polaren Lösungsmitteln, hingegen gut in Chloroform und Chloroform-Methanol-Gemischen. Gereinigtes Staphyloxanthin löst sich sehr gut in Petrolether.
Isoliertes Staphyloxanthin weist ein Absorptionsmaximum im sichtbaren Licht bei einer Wellenlänge von λ=460 nm im Lösungsmittel Methanol oder Aceton auf und ein Absorptionsmaximum von λ=462 nm mit einem kleinen Seitenpeak bei λ=491 nm in Petrolether auf.[18] HPLC-UV-Analysen von aufgereinigtem Staphyloxanthin zeigten unter Verwendung eines linearen Aceton/Wassergradienten ein Absorptionsspektrum mit Peaks bei 463 nm und einem Seitenpeak bei 490 nm.[1]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Die fünf Strukturgene zur Synthese von Staphyloxanthin liegen in dem Operon crtOPQMN (CrtO, CrtP, CrtQ, CrtM und CrtN).[1] Das AldH-Gen in Staphylococcus aureus, das sich 670 Kilobasenpaare jenseits des Operons befindet, kodiert für eine 4,4′-Diaponeurosporen-Aldehyd-Dehydrogenase (AldH). Dieses Enzym ist vermutlich für die vollständige Synthese des Farbstoffs von Bedeutung. Fehlt dieses Gen, akkumuliert 4,4′-Diaponeurosporen-4-al und wird nicht in Staphyloxanthin überführt.[19]
Syntheseweg
[Bearbeiten | Quelltext bearbeiten]Die Synthese der Triterpene beginnt mit der Kondensation von zwei Molekülen Farnesylpyrophosphat (FPP) C15H25O7P23− zu 4,4′-Diapophytoen (Dehydrosqualen) C30H48, katalysiert durch die Dehydrosqualensynthetase (CrtM).[20] Aus der folgenden Oxidation durch die Dehydrosqualen-Desaturase CrtN geht das gelbe Zwischenprodukt 4,4-Diaponeurosporen C30H42 hervor. 4,4-Diaponeurosporen zeigt in einem Petroleum-Acetongemisch ein Absorptionsspektrum mit drei Peaks bei den Wellenlängen von 412 nm, 435 nm und 465 nm.[18] 4,4-Diaponeurosporen C30H42 wird zur Säure 4,4-Diaponeurosporensäure C30H40O2 oxidiert (Gen CrtP).[1]
Die Glycosyltransferase CrtQ verestert die Hydroxygruppe der Glucose am ersten C-Atom mit der 4,4-Diaponeurosporensäure. Im letzten Biosyntheseschritt findet die Verknüpfung der 12-Methyltetradecansäure, einer C15-Fettsäure, mit der Hydroxygruppe am sechsten C-Atom der Glucose zu dem goldgelben Pigment Staphyloxanthin statt.[19]
Regulation
[Bearbeiten | Quelltext bearbeiten]Die Staphyloxanthin-Biosynthese ist sehr komplex und kann auf verschiedenen Stoffwechselebenen reguliert werden. Das Operon, in dem die Gene der Biosynthese organisiert sind, wird von einem Sigma-Faktor (B)-abhängigen Promotor reguliert und durch eine Terminator-Sequenz beendet. Der alternative Sigma-Faktor B, der an eine bestimmte DNA-Sequenz im crt-Promotorbereich des Operons bindet, reguliert direkt die Synthese von Staphyloxanthin.[21] Deletions-Mutanten, die keinen Sigma-Faktor besitzen, waren weiß und zeigten keine Pigmentbildung.[22]
Darüber hinaus beeinflusst das vom Sigma-Faktor abhängige Kälteschockprotein A (CspA) als positiver Regulator das Operon und die Synthese der Stoffwechselprodukte.[23]
Zusätzlich zu diesen Mechanismen wirken weitere Signaltransduktions-Systeme auf den Staphylokokken-Metabolismus und auf die Staphyloxanthin-Synthese.[24][25]
Staphyloxanthin als mögliches Target in der antimikrobiellen Therapie
[Bearbeiten | Quelltext bearbeiten]
Staphylococcus aureus gehört zur normalen Besiedlungsflora des Menschen und besiedelt vor allem die Haut und die Schleimhäute. Erst bei einer Immunschwäche, bedingt durch Grunderkrankungen des Menschen, treten – teilweise schwerwiegende – Staphylococcus-aureus-Infektionen auf, wie beispielsweise Mastitis, postoperative Wundinfektionen und Furunkeln. Neben dem Staphyloxanthin, dem Hauptpathogenitätsfaktor, bildet dieser Keim eine Vielzahl weiterer extrazellulärer Virulenzfaktoren wie Hämolysine, Koagulase, Toxisches Schocksyndrom und Protein A. Gefürchtet werden auch die durch Staphylokokken hervorgerufenen Lebensmittelvergiftungen durch Enterotoxine.[21][26]
Bis in die 1990er Jahre traten gegen das Antibiotikum Methicillin resistente Staphylokokken (MRSA) ausschließlich in Krankenhäusern auf. Danach nahm die Verbreitung antibiotikaresistenter Infektionen auch außerhalb von Krankenhäusern zu, seit 2005 werden MRSA-Infektionen auch bei Nutztieren beobachtet.[27] Aufgrund auftretender Multidrug-Resistenzstämme, sogenannter Superkeime, sind diese MRSA-Erreger auch gegen alle anderen β-Lactam-Antibiotika resistent, die ursprünglich zur Behandlung von Staphylococcus-aureus-Infektionen eingesetzt worden waren. Die medizinische Behandlung von Infektionen durch solche Mikroben, die sich als Vertreter der Linezolid-resistenten MRSA (LRSA) und der Vancomycin-intermediären und -resistenten MRSA (VISA und VRSA) erweisen, erfordert eine rasche Entwicklung neuer Antiinfektiva.[28][29]
Behandlung mit Rhodomyrtus-Extrakt
[Bearbeiten | Quelltext bearbeiten]
Rhodomyrtus tomentosa (Aiton) Hassk. ist eine immergrüne Strauchpflanze der Gattung Rhodomyrtus, die zur Familie der Myrtengewächse gehört. Die Pflanze kommt im Süden und Südosten Asiens vor und wurde in der traditionellen chinesischen und malaysischen Medizin zur Behandlung verschiedener bakterieller Entzündungen verwendet. In mehreren Studien konnte 2019 von den Wissenschaftlern Thanh Sang Vo und Dai Hung Ngo die Wirkung der biologisch aktiven Metabolite von Rhodomyrtus auf verschiedene Mikroorganismen gezeigt werden.[30]
In Staphylococcus aureus hemmte ein Extrakt aus Rhodomyrtus tomentosa die Staphyloxanthin-Biosynthese und setzte die Resistenz gegenüber Wasserstoffperoxid und Singulettsauerstoff herab.[31] Darüber hinaus konnten Störungen der bakteriellen Zellwand-Biosynthese und der Zellteilung sowie Hemmungen verschiedener Enzyme von wichtigen Stoffwechselwegen von Staphylococcus aureus nachgewiesen werden, was die Vitalität dieser Bakterien gegenüber solchen ohne Behandlung mit dem Extrakt minderte.[32]
Den Wirkstoffen aus Rhodomyrtus kann nach den Studien eine die bakterielle Zellmembran schädigende Wirkung zugesprochen werden sowie eine Veränderung der Fluidität der Zellmembran.[33][30]
Bestrahlung mit blauem Licht
[Bearbeiten | Quelltext bearbeiten]In einer Studie im Jahr 2019 konnten Pu-Ting Dong u. a. an Biofilmen von Staphylococcus aureus und an Wundinfektionen bei Mausmodellen zeigen, dass Staphyloxanthin durch die Bestrahlung mit blauem Licht photochemisch zersetzt wurde und damit seine antioxidative Wirkung verlor. Die orange pigmentierten MRSA-Keime zeigten nach Bestrahlung im sichtbaren Lichtwellenlängenbereich von λ=460 nm eine veränderte Membranpermeabilität. Diese führte zu einer erhöhten Empfindlichkeit der Mikroben gegenüber Wasserstoffperoxid und anderen reaktiven Sauerstoffverbindungen. Die synergistische Wirkung von Photobleichung und schwachen Desinfektionsmitteln könnte für eine neue therapeutische Behandlungsmethode zur Bekämpfung von MRSA-Infektionen vielversprechend eingesetzt werden.[3]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Compound – C16148 in der Kyoto Encyclopedia of Genes and Genomes
- Eintrag CHEBI:71690 in der ChEBI-Datenbank des Europäischen Laboratoriums für Molekularbiologie (EMBL)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Alexandra Pelz, Karsten-Peter Wieland, Karsten Putzbach, Petra Hentschel, Klaus Albert, Friedrich Götz: Structure and Biosynthesis of Staphyloxanthin from Staphylococcus aureus. In: Journal of Biological Chemistry, 280, 37, 16. September 2005, S. 32493–32498, doi:10.1074/jbc.M505070200.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Pu‐Ting Dong, Haroon Mohammad, Jie Hui, Leon G. Leanse, Junjie Li, Lijia Liang, Tianhong Dai, Mohamed N. Seleem, Ji‐Xin Cheng: Photolysis of Staphyloxanthin in Methicillin‐Resistant Staphylococcus aureus Potentiates Killing by Reactive Oxygen Species. In: Advanced Science 6 (11), 30. März 2019, doi:10.1002/advs.201900030, PMID 31179216, PMC 6548961 (freier Volltext).
- ↑ Chia-I Liu, George Y. Liu, Yongcheng Song, Fenglin Yin, Mary E. Hensler, Wen-Yin Jeng, Victor Nizet, Andrew H.-J. Wang, Eric Oldfield: A Cholesterol Biosynthesis Inhibitor Blocks Staphylococcus aureus Virulence. In: Science 319 (5868), März 2008, S. 1391–1394, doi:10.1126/science.1153018, PMC 2747771 (freier Volltext).
- ↑ Mary Barber: Pigment Production by Staphylococci. In: Microbiology 13, 2, 1. Oktober 1955, S. 338–345, doi:10.1099/00221287-13-2-338.
- ↑ Kiran B. Tiwari, Craig Gatto, Brian J. Wilkinson: Interrelationships among Fatty Acid Composition, Staphyloxanthin Content, Fluidity, and Carbon Flow in the Staphylococcus aureus Membrane. In: Molecules 2018, 23(5), 1201, doi:10.3390/molecules23051201.
- ↑ mitgeteilt in Alexandra Pelz, Karsten-Peter Wieland, Karsten Putzbach, Petra Hentschel, Klaus Albert, Friedrich Götz: Structure and Biosynthesis of Staphyloxanthin from Staphylococcus aureus. In: Journal of Biological Chemistry, 280, 37, 16. September 2005, S. 32493–32498, doi:10.1074/jbc.M505070200, PMID 16020541.
- ↑ John H. Marshall, E. S. Rodwell in: 3rd International Symposium on Carotenoids Other Than Vitamin A, 4.–7. September 1972, S. 56–57, International Union of Pure and Applied Chemisry, Cluj, Romania.
- ↑ John H. Marshall, Gregory J. Wilmoth: Pigments of Staphylococcus aureus, a Series of Triterpenoid Carotenoids. In: Journal of Bacteriology 147, 3, September 1981, S. 900–913, PMID 7275936, PMC 216126 (freier Volltext),.
- ↑ Nancy E. Holt, Donatas Zigmantas, Leonas Valkunas, Xiao-Ping Li, Krishna K. Niyogi, Graham R. Fleming: Carotenoid Cation Formation and the Regulation of Photosynthetic Light Harvesting. In: Science 307, 5708, 21. Januar 2005, S. 433–436, doi:10.1126/science.1105833, PMID 15662017.
- ↑ Ethan T. Johnson, Claudia Schmidt-Dannert: Light-energy conversion in engineered microorganisms. In: Trends in Biotechnology 26 (12), Dezember 2008, S. 682–689, doi:10.1016/j.tibtech.2008.09.002. PMID 18951642.
- ↑ Henry Rosen, Seymor J. Klebanoff: Bactericidal activity of a superoxide anion-generating system. A model for the polymorphonuclear leukocyte. In: Journal of Experimental Medicine 149(1), Januar 1979, S. 27–39, doi:10.1084/jem.149.1.27, PMID 216766, PMC 2184741 (freier Volltext).
- ↑ Thomas A. Dahl, W. Robert Midden, Philipe Hartman: Comparison of Killing of Gram-Negative and Gram-Positive Bacteria by Pure Singlet Oxygen. In: Journal of Bacteriology 171(4), April 1989, S. 2188–2194, doi:10.1128/jb.171.4.2188-2194.1989, PMID 2703469, PMC 209876 (freier Volltext).
- ↑ Norman I. Krinsky: Actions of Carotenoids in Biological Systems. In: Annual Review of Nutrition 13, Juli 1993, S. 561–587, doi:10.1146/annurev.nu.13.070193.003021, PMID 8369159.
- ↑ Chia-I Liu, George Y. Liu, Yongcheng Song, Fenglin Yin, Mary E. Hensler, Wen-Yih Jeng, Victor Nizet, Andrew H.-J. Wang, Eric Oldfield: A Cholesterol Biosynthesis Inhibitor Blocks Staphylococcus aureus Virulence. In: Science 319 (5868), März 2008, S. 1391–1394, doi:10.1126/science.1153018, PMID 18276850, PMC 2747771 (freier Volltext).
- ↑ a b Alexandra Clauditz, Alexandra Resch, Karsten-Peter Wieland, Andreas Peschel, Friedrich Götz: Staphyloxanthin Plays a Role in the Fitness of Staphylococcus aureus and Its Ability To Cope with Oxidative Stress. In: Infection and Immunity 74 (8), August 2006, S. 4950–4953, doi:10.1128/IAI.00204-06, PMID 16861688, PMC 1539600 (freier Volltext).
- ↑ I. A. Popov, A. S. Kaprel'iants, D. N. Ostrovskiĭ, V. V. Ignatov: [Study of the membranes of pigment-free mutant of Staphylococcus aureus] (Artikel in russischer Sprache). In: Biokhimiia 41 (6), Juli 1976, S. 1116–1120, PMID 1027489.
- ↑ a b John H. Marshall, Gregory J. Wilmoth: Pigments of Staphylococcus aureus, a Series of Triterpenoid Carotenoids. In: Journal of Bacteriology 147, 3, September 1981, S. 900–913, PMID 7275936, PMC 216126 (freier Volltext).
- ↑ a b Se Hyeuk Kim, Pyung Cheon Lee: Functional Expression and Extension of Staphylococcal Staphyloxanthin Biosynthetic Pathway in Escherichia coli. In: Journal of Biological Chemistry 287, 26, 22. Juni 2012, S. 21575–21583, doi:10.1074/jbc.M112.343020, PMID 22535955, PMC 3381123 (freier Volltext).
- ↑ Bernd Wieland, Corinna Feil, Eva Gloria-Maercker, Günther Thumm, Max Lechner, Jean-Michel Bravo, Karl Poralla, Friedrich Götz: Genetic and Biochemical Analyses of the Biosynthesis of the Yellow Carotenoid 4,4'-Diaponeurosporene of Staphylococcus aureus. In: Journal of Biological Chemistry 176, 24, Dezember 1994, S. 7719–7726, doi:10.1128/jb.176.24.7719-7726.1994, PMID 8002598, PMC 197231 (freier Volltext).
- ↑ a b Jeffrey W. Hall, Junshu Yang, Haiyong Guo, Yinduo Ji: The Staphylococcus aureus AirSR Two-Component System Mediates Reactive Oxygen Species Resistance via Transcriptional Regulation of Staphyloxanthin Production. In: Infection and Immunity 85 (2), 26. Januar 2017, doi:10.1128/IAI.00838-16, PMID 27872240, PMC 5278164 (freier Volltext).
- ↑ Ines Kullik, Philipp Giachino, Thomas Fuchs: Deletion of the Alternative Sigma Factor ςB in Staphylococcus aureus Reveals Its Function as a Global Regulator of Virulence Genes In: Journal of Biological Chemistry 180 (18), September 1998, S. 4814–4820, PMID 9733682, PMC 107504 (freier Volltext).
- ↑ Samuel Katzif, Eun-Hee Lee, Anthony B. Law, Yih-Ling Tzeng, William M. Shafer: CspA Regulates Pigment Production in Staphylococcus aureus through a SigB-Dependent Mechanism. In: Journal of Bacteriology 187 (23), Dezember 2005, S. 8181–8184, doi:10.1128/JB.187.23.8181-8184.2005, PMID 16291691, PMC 1291268 (freier Volltext).
- ↑ Meiying Yan, Jeffrey W. Hall, Junshu Yang, Yinduo Ji: The Essential yhcSR Two-Component Signal Transduction System Directly Regulates the lac and opuCABCD Operons of Staphylococcus aureus. In: PLoS One 7 (11), 30. November 2012, doi:10.1371/journal.pone.0050608, PMID 23226327, PMC 3511567 (freier Volltext).
- ↑ Jeffrey W. Hall, Junshu Yang, Haiyong Guo, Yinduo Ji: The Staphylococcus aureus AirSR Two-Component System Mediates Reactive Oxygen Species Resistance via Transcriptional Regulation of Staphyloxanthin Production. In: Infection and Immunity 85 (2), 26. Januar 2017, doi:10.1128/IAI.00838-16, PMID 27872240, PMC 5278164 (freier Volltext).
- ↑ Stien Vandendriessche, Wannes Vanderhaeghen, Filomena Valente Soares, Marie Hallin, Boudewijn Catry, Katleen Hermans, Patrick Butaye, Freddy Haesebrouck, Marc J. Struelens, Olivier Denis: Prevalence, risk factors and genetic diversity of methicillin-resistant Staphylococcus aureus carried by humans and animals across livestock production sectors. In: Journal of Antimicrobial Chemotherapy 68 (7), Juli 2013, S. 1510–1516, doi:10.1093/jac/dkt047, PMID 23429641.
- ↑ Bundesministerium für Gesundheit: MRSA, Information des Ministeriums vom 29. Mai 2019; abgerufen am 1. Dezember 2019.
- ↑ Robert S. Daum: Removing the Golden Coat of Staphylococcus aureus. In: New England Journal of Medicine 359 (1), 3. Juli 2008, S. 85–87, doi:10.1056/NEJMcibr0803278, PMID 18596277.
- ↑ Chia-I Liu, George Y. Liu, Yongcheng Song, Fenglin Yin, Mary E. Hensler, Wen-Yih Jeng, Victor Nizet, Andrew H.-J. Wang, Eric Oldfield: A Cholesterol Biosynthesis Inhibitor Blocks Staphylococcus aureus Virulence. In: Science 319 (5868), 7. März 2008, S. 1391–1394, doi:10.1126/science.1153018, PMID 18276850, PMC 2747771 (freier Volltext).
- ↑ a b Thanh Sang Vo, Dai Hung Ngo: The Health Beneficial Properties of Rhodomyrtus tomentosa as Potential Functional Food. In: Biomolecules 9 (2), 76, 21. Februar 2019, doi:10.3390/biom9020076, PMID 30795643, PMC 6406238 (freier Volltext).
- ↑ Sukanlaya Leejae, Laila Hasap, Supayang Piyawan Voravuthikunchai: Inhibition of staphyloxanthin biosynthesis in Staphylococcus aureus by rhodomyrtone, a novel antibiotic candidate. In: Journal of Medical Microbiology 62 (3), März 2013, S. 421–428, doi:10.1099/jmm.0.047316-0, PMID 23242641.
- ↑ Wipawadee Sianglum, Potjanee Srimanote, Wijit Wonglumsom, Kanokwan Kittiniyom, Supayang P. Voravuthikunchai: Proteome Analyses of Cellular Proteins in Methicillin-Resistant Staphylococcus aureus Treated with Rhodomyrtone, a Novel Antibiotic Candidate. In: PLoS One 6 (2), 4. Februar 2011, doi:10.1371/journal.pone.0016628, PMID 21326597, PMC 3033880 (freier Volltext).
- ↑ Wipawadee Sianglum, Dennapa Saeloh, Pongsri Tongtawe, Natthakul Wootipoom, Nitaya Indrawattana, Supayang Piyawan Voravuthikunchai: Early Effects of Rhodomyrtone on Membrane Integrity in Methicillin-Resistant Staphylococcus aureus. In: Microbial Drug Resistance 24 (7), 1. September 2018, S. 882–889, doi:10.1089/mdr.2016.0294, PMID 29215320.