1,3-Diamino-2-propanol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,3-Diamino-2-propanol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H10N2O | ||||||||||||||||||
| Kurzbeschreibung |
weißer bis schwachgelber Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 90,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
1,3-Diamino-2-propanol ist der einfachste Aminoalkohol mit zwei primären Aminogruppen und einer sekundären Alkoholgruppe. Wässrige Lösungen des Diamins reagieren alkalisch und absorbieren ähnlich wie Lösungen von z. B. Diethanolamin in Aminwäschern sehr effizient saure Gase, wie Kohlendioxid und Schwefelwasserstoff aus industriellen Abgasen.[5]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Hinweise auf die Entstehung von 1,3-Diamino-2-propanol (neben höheren Kondensationsprodukten) erhielt A. Claus bei der Reaktion von 1,3-Dichlor-2-propanol mit Ammoniak bereits 1873.[7]
Eine frühe Standardvorschrift beschreibt die Umsetzung von 1,3-Dichlor-2-propanol (aus Glycerin und Chlorwasserstoff)[8] mit überschüssigem Ammoniak bei 30 °C in Gegenwart von Natronlauge als Säurefänger zum 1,3-Diamino-2-propanol[5]
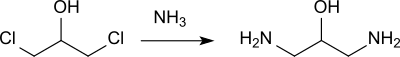
Die Ausbeuten bei diesem Syntheseweg liegen unterhalb 40 %.[9]
Die Reaktion des im Vergleich zu 1,3-Dichlor-2-propanol wesentlich preisgünstigeren Epichlorhydrins mit Ammoniak in großem Überschuss (> 20-fach) bei 30 °C und anschließendem Erhitzen führt hauptsächlich zur Bildung von höherkondensierten Aminen und liefert nur ca. 15 % 1,3-Diamino-2-propanol.[10]
In einem zweistufigen Prozess reagiert Epichlorhydrin mit einem 30–50-fachem Ammoniaküberschuss bei 10 °C zunächst unter Öffnung des Oxiranrings. Anschließend wird eine mit dem Epichlorhydrin äquimolaren Menge Natronlauge bei 10–20 °C zugefügt. Nach Abziehen des überschüssigen Ammoniaks und Abfiltrieren des ausgefallenen NaCl wird das rohe Diamin in ca. 80%iger Ausbeute erhalten, das noch 15–20 % höherer Amine enthält. Nach Vakuumdestillation fallen 64 % reines 1,3-Diamino-2-propanol an.[9]

Eine jüngere Prozessvariante verwendet einen stark alkalischen Anionenaustauscher zur Bindung des entstehenden Chlorwasserstoffs und Vermeidung der Abtrennung von Natriumchlorid wie bei der Variante nach Enders[9], wobei reproduzierbar Ausbeuten von 52–55 % erzielt werden.[4]
Das isomere 2,3-Diamino-1-propanol wird dabei nicht gebildet. Hinweise auf die vergleichsweise höhere Stabilität des 1,3-Diamino-2-propanols liefert auch der Versuch[11] der Überführung des 2,3-Dibrom-1-propanols mit Phthalimidkalium in einer Gabriel-Synthese zum Diphthalimid und dessen anschließender Spaltung mit 48%iger Bromwasserstoffsäure zum 2,3-Diamino-1-propanol, bei der jedoch – wahrscheinlich über ein intermediär gebildetes Epoxid – 1,3-Diamino-2-propanol entsteht.
Die Darstellung von 1,3-Diamino-2-propanol erfordert die Zugabe von Epichlorhydrin und zu einem sehr hohen Ammoniaküberschuss bei Temperaturen unterhalb von 30 °C, um die Bildung von Nebenprodukten, meist oligomere Kondensationsprodukte, zu unterdrücken. So entsteht bei einem 1:3-Verhältnis Ammoniak zu Epichlorhydrin in Methanol N,N,N-Tris(3-chlor-2-hydroxypropyl)amin[12]

oder bei der Reaktion äquimolarer Mengen bei 70–75 °C hochverzweigte Polymere, die in der Papierherstellung Verwendung finden können.[13]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
1,3-Diamino-2-propanol ist ein weißer, aminartig riechender Feststoff, der in Wasser sehr gut und in Alkoholen gut löslich ist.
Verwendung[Bearbeiten | Quelltext bearbeiten]
In einer Strecker-Synthese mit Blausäure und Formaldehyd und anschließender Hydrolyse des entstandenen Tetranitrils ist der Komplexbildner 1,3-Diamino-2-propanol-N,N,N′,N′-tetraessigsäure zugänglich, dessen Chelatkomplexe mit zweiwertigen Kationen erheblich geringere Stabilitäten aufweisen als die mit dem Standard EDTA[14]

Die Reaktion von 1,3-Diamino-2-propanol mit Paraformaldehyd erzeugt in 88%iger Ausbeute den sechsgliedrigen gesättigten Heterocyclus 5-Hydroxy-1,3-diazacyclohexan, einen wasserlöslichen hygroskopischen Feststoff,[15]
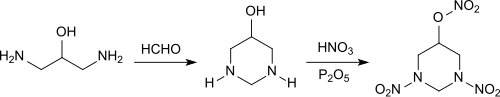
der mit 100%iger Salpetersäure und Phosphorpentoxid in 80%iger Ausbeute zu 1,3-Dinitro-5-nitrato-1,3-diazacyclohexan, einem potentiellen Explosivstoff, reagiert.
Die Umsetzung von 1,3-Diamino-2-propanol mit langkettigen Carbonsäurechloriden liefert N,N′-Diacyl-1,3-diamino-2-propanole. Diese stellen Amid-Isostere von 1,3-Diacylglycerin, der Synthesevorstufe für Membranlipide dar.[16]

Die Schwerlöslichkeit der Diacylamido-2-propanole in praktisch allen Lösungsmitteln[17] und die wenig reaktive sekundäre Alkoholgruppe erzwingt Alternativrouten zur Überführung in das reaktive Phosphordichloridat, die Zwischenstufe für 1,3-Diamidophospholipide als Analoga zu natürlichen Membranlipiden wie z. B. Lecithine.[18]
Die so erhaltenen künstlichen 1,3-Diamidophospholipide bilden Liposomen, die – im Gegensatz zu Liposomen aus natürlichen und anderen künstlichen Phospholipiden – das Komplementsystem nicht aktivieren[19] und daher als Wirkstoffträger (engl. drug carrier) einsetzbar sein könnten.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Datenblatt 1,3-Diamino-2-propanol bei Alfa Aesar, abgerufen am 24. März 2016 (Seite nicht mehr abrufbar).
- ↑ a b c Datenblatt 1,3-Diamino-2-propanol bei Sigma-Aldrich, abgerufen am 24. März 2016 (PDF).
- ↑ a b Eintrag zu 1,3-Diamino-2-propanol bei TCI Europe, abgerufen am 24. März 2016.
- ↑ a b Patent EP0359956A2: Verfahren und Vorrichtung zur Herstellung von 1,3-diaminopropanol-2. Angemeldet am 3. August 1989, veröffentlicht am 28. März 1990, Anmelder: Deutsche Solvay-Werke GmbH, Erfinder: G. Jakobson, M. Klumpe.
- ↑ a b c d Patent US1985885: Preparation of 1,3-diamino-2-propanol. Angemeldet am 23. November 1931, veröffentlicht am 1. Januar 1935, Anmelder: The Girdler Corp., Erfinder: R.R. Bottoms.
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, Boca Raton, FL, U.S.A. 2015, ISBN 978-1-4822-6097-7, S. 3–146.
- ↑ A. Claus: III. Einwirkung von Ammoniak auf Dichlorhydrin. In: Justus Liebigs Ann. Chem. Band 168, Nr. 1, 1873, S. 29–41, doi:10.1002/jlac.18731680104.
- ↑ J.B. Conant, O.R. Quayle: Glycerol, α,γ-dichlorohydrin In: Organic Syntheses. 2, 1922, S. 29, doi:10.15227/orgsyn.002.0029; Coll. Vol. 1, 1941, S. 292 (PDF).
- ↑ a b c Patent US3432553: Process for manufacturing 1,3-diaminopropanol-(2). Angemeldet am 28. September 1966, veröffentlicht am 11. März 1969, Anmelder: Chemische Fabrik Pfersee GmbH, Erfinder: H. Enders, G. Pusch.
- ↑ Patent US2864775: Process for curing polyepoxides by amine adducts and resulting products. Angemeldet am 20. September 1955, veröffentlicht am 16. Dezember 1958, Anmelder: Shell Development Co., Erfinder: H.A. Newey.
- ↑ M.S. Okamoto, E.K. Barefield: Synthesis and stereochemistry of cobalt(III) complexes of 1,3-diamino-2-propanol and related ligands. In: Inorg. Chem. Band 13, Nr. 11, 1974, S. 2611–2617, doi:10.1021/ic50141a016.
- ↑ J.B. McKelvey, B.G. Webre, R.R. Benerito: Reaction of epichlorohydrin with ammonia, aniline, and diethanolamine. In: J. Org. Chem. Band 25, Nr. 8, 1960, S. 1424–142, doi:10.1021/jo01078a035.
- ↑ Patent US7431799B2: Epichlorohydrin-based polymers containing primary amino groups used as additives in papermaking. Angemeldet am 23. Februar 2005, veröffentlicht am 7. Oktober 2008, Anmelder: FPInnovations, Erfinder: M. Antal, I.I. Pikulik, X. Hua.
- ↑ V. Jokl, J. Majer: Investigation of complex compounds in solution using paper electrophoresis. IV. Complexes of 1,3-diamino-2-propanol-N,N,N',N'-tetraacetic acid. In: Chem. Pap. Band 19, Nr. 4, 1965, S. 249–258 (chempap.org).
- ↑ T. Axenrod, J. Sun, K.K. Das, P.R. Dave, F. Forohar, M. Kaselj, N.J. Trivedi, R.D. Gilardi, J.L. Flippen-Anderson: Synthesis and Characterization of 5-substituted-1,3-diazacyclohexane derivatives. In: J. Org. Chem. Band 65, Nr. 4, 2000, S. 1200–1206, doi:10.1021/jo991524o.
- ↑ F. Mergen, D.M. Lambert, J.H. Poupaert, A. Bidaine, P. Dumont: Synthesis of 1,3-diacylaminopropan-2-ols and corresponding 2-acyl derivatives as amide isosteres of natural lipids. In: Chem. Phys. Lipids. Band 59, Nr. 3, 1991, S. 267–272, doi:10.1016/0009-3084(91)90027-9.
- ↑ P.-L. Zaffalon, V. D’Anna, H. Hagemann, A. Zumbuehl: Study of surfactants alcohols with various chemical moieties at the hydrophilic-hydrophobic interface. In: RSC Advances. Band 3, 2013, S. 7237–7244, doi:10.1039/c3ra40704g.
- ↑ I.A. Fedotenko, P.-L. Zaffalon, F. Favarger, A. Zumbuehl: The synthesis of 1,3-diamidophospholipids. In: Tetrahedron Lett. Band 51, 2010, S. 5382–5384, doi:10.1016/j.tetlet.2010.07.140.
- ↑ S. Bugna et al.: Surprising lack of liposome-induced complement acivation by artificial 1,3-diamidophospholipids in vitro. In: Nanomedicine. Band 12, Nr. 3, 2016, S. 845–849, doi:10.1016/j.nano.2015.12.364.
