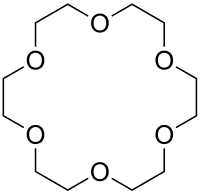
18-Krone-6
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | [18]Krone-6 | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C12H24O6 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 264,32 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[3] | |||||||||||||||
| Dichte |
1,175 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
116 °C (bei 0,2 mmHg)[2] | |||||||||||||||
| Löslichkeit |
löslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
[18]Krone-6 ist eine chemische Verbindung aus der Gruppe der Kronenether.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
[18]Krone-6 kann durch eine modifizierte Williamson-Ethersynthese von Triglycoldichlorid[4] und Triethylenglycol in Gegenwart eines Template-Kations gewonnen werden:[5]

Ebenfalls möglich ist die Darstellung durch Oligomerisierung von Ethylenoxid.[6] Die Verbindung lässt sich auch in mehr als 90%iger Ausbeute aus Kalium-tert-butanolat und Triethylenglycolditosylat herstellen.[7]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
[18]Krone-6 ist ein hellgelber Feststoff.[3] Im Jahr 1967 entdeckte Charles Pedersen die besondere Eigenschaft der Verbindung, dass sie als Wirt in einer Wirt-Gast-Beziehung mit einem Kaliumkation stehen kann.[8] Grund ist, dass die Größe des Ringes der Verbindung zwischen 2,3 und 3,2 Å liegt und damit mit der Größe des Kaliums-Ions (2,66 Å) recht gut übereinstimmt.[9] Bei der Wirt-Gast-Beziehung binden Ionen-Dipol-Wechselwirkungen das positiv geladene Kaliumion im Inneren des Macrocyclus mit den negativ polarisierten Sauerstoffatomen des Ethers. Dadurch werden Kaliumsalze in Lösungsmitteln löslich, in denen sie vorher unlöslich waren. In Gegenwart von [18]Krone-6 sind daher typische anorganische Salze wie Kaliumpermanganat in Lösungsmitteln wie Benzol löslich. Die Anionen der Kaliumsalze stehen durch die Maskierung des Kaliumions zur Reaktion bereit. Es bilden sich so stabile Komplexverbindungen. Die Stabilität solcher Komplexe ist um zirka den Faktor 100 größer als solche mit Natrium- oder Rubidiumionen.[8][10]
Verwendung[Bearbeiten | Quelltext bearbeiten]
[18]Krone-6 kann für Phasentransferkatalysen verwendet werden. Die Verbindung kann (wie weitere Kronenether) als Phasentransfer-Katalysatoren wirken, weil sie Alkalimetallionen „organisch maskiert“ und sie zusammen mit ihrem Anion in unpolare organische Lösungsmittel extrahieren können. Sie schirmt die positive Ladung des Kations ab und fördern somit in polaren aprotischen Lösungsmitteln die Dissoziation des Ionenpaares. In weniger polaren Lösungsmitteln begünstigen sie die Bildung von lockeren, durch Lösungsmittelmoleküle getrennten Ionenpaaren mit höherer Reaktivität.[3][11]
Verwandte Verbindungen[Bearbeiten | Quelltext bearbeiten]
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu CYCLO PEG-6 in der CosIng-Datenbank der EU-Kommission, abgerufen am 30. Dezember 2021.
- ↑ a b c d Datenblatt 18-Crown-6, 99% bei Alfa Aesar, abgerufen am 20. Oktober 2017 (Seite nicht mehr abrufbar).
- ↑ a b c d e f g h i Datenblatt 18-Krone-6, ≥99.0% bei Sigma-Aldrich, abgerufen am 20. Oktober 2017 (PDF).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Triglycoldichlorid: CAS-Nummer: 112-26-5, EG-Nummer: 203-952-7, ECHA-InfoCard: 100.003.593, PubChem: 8171, ChemSpider: 7879, Wikidata: Q27254323.
- ↑ George W. Gokel, Donald J. Cram, Charles L. Liotta, Henry P. Harris, and Fred L. Cook: 18-Krone-6 In: Organic Syntheses. 6, 1988, S. 301, doi:10.15227/orgsyn.057.0030 (PDF).
- ↑ Jonathan W. Steed, Jerry L. Atwood: Supramolecular Chemistry. Wiley, 2009, ISBN 978-0-470-74089-7 (englisch).
- ↑ Kronenether - Lexikon der Chemie. In: spektrum.de. Abgerufen am 14. September 2015.
- ↑ a b Die Kraft des Nichtkovalenten - academics. In: academics.de. Archiviert vom (nicht mehr online verfügbar) am 27. Oktober 2017; abgerufen am 14. September 2015.
- ↑ Helmut Günzler, A. Müfit Bahadir, Klaus Danzer, Werner Engewald, Wilhelm Fresenius, Rudolf Galensa, Walter Huber, Michael Linscheid, Georg Schwedt, Günter Tölg: Analytiker-Taschenbuch. Springer-Verlag, 2013, ISBN 978-3-642-72167-0 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ahmad Zaeni: Synthese, Charakterisierung und Kristallstrukturuntersuchungen neuer Organometallverbindungen der Lanthanoide und der Alkalimetalle mit Fluorenyl- und substituierten Fluorenylliganden. Cuvillier Verlag, 2004, ISBN 3-86537-258-9 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Kurzeinführung in die Phasentransfer-Katalyse. In: uni-bielefeld.de. www.uni-bielefeld.de, abgerufen am 14. September 2015.
