2-Azetidinon
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Azetidinon | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H5NO | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 71,08 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
2-Azetidinon ist das cyclische Amid der nichtproteinogenen Aminosäure β-Alanin und das einfachste, viergliedrige β-Lactam. 2-Azacyclobutanone sind Leitstrukturen in β-Lactam-Antibiotika, wie den monocyclischen Monobactamen und insbesondere in den anellierten bicyclischen Penam- und Cephem-Grundgerüsten, die den Penicillinen bzw. Cephalosporinen zugrunde liegen.[5] 2-Azacyclobutanon kann als Lactam-Monomer anionisch zu Poly-(β-Alanin) bzw. Polyamid 3 polymerisiert werden.[6]
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
Die Synthese von (phenylsubsituiertem) 2-Azetidinon durch (2+2)-Cycloaddition von Diphenylketen an Benzalanilin wurde erstmals 1907 von Hermann Staudinger beschrieben.[7]

Einen guten Zugang zum Zielmolekül 2-Azacyclobutanon eröffnet die Verbindung 4-Acetoxy-2-azetidinon[8][9][10], die aus Vinylacetat und Chlorsulfonylisocyanat in einer (2+2)-Cycloaddition in Ausbeuten von 44–62 % zugänglich ist.
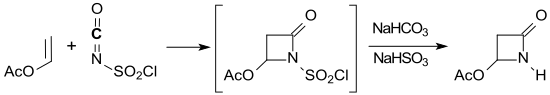
Bei der Reduktion von 4-Acetoxy-2-azetidinon mit Kaliumborhydrid in Wasser wird nach Kurzwegdestillation 2-Azetidinon in 20%iger Ausbeute erhalten.[10]
Die analoge Cycloaddition von Ethylen mit Chlorsulfonylisocyanat mit anschließender Hydrolyse zur Synthese des unsubstituierten 2-Azetidinons führt wegen der Reaktionsträgheit des Ethylens nicht zum gewünschten Endprodukt 2-Azacyclobutanon.[6]
Das unsubstituierte 2-Azetidinon wurde im Jahr 1949 erstmals durch Cyclisierung von β-Alaninethylester mit Ethylmagnesiumbromid in Diethylether nach aufwendiger Isolierung und Reinigung in einer Gesamtausbeute von lediglich 0,76 % erhalten.[1]
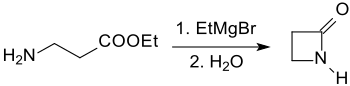
Wesentlich leistungsfähiger ist die Michael-Addition von Benzylamin an Acrylsäureester zum N-Benzyl-β-alaninester, der mit Ethylmagnesiumbromid zum N-Benzyl-β-propiolactam cyclisiert werden kann. Die reduktive Abspaltung des Benzylrestes mit Natrium in flüssigem Ammoniak liefert 2-Azetidinon in einer Gesamtausbeute von 50 %.[6]

Eigenschaften[Bearbeiten | Quelltext bearbeiten]
2-Azetidinon ist ein farb- und geruchloser Feststoff, der sich in polaren Lösungsmitteln, wie Wasser und Ethanol, leicht löst. Verdünnte Natronlauge hydrolysiert das Lactam zum β-Alanin-Natriumsalz. β-Propiolactam ist wesentlich weniger reaktiv als Propiolacton, das mit Methanol bei 48 °C ohne Katalysator vollständig zur β-Methoxypropionsäure reagiert, während 2-Azetidinon keine Reaktion zeigt.[1]
Anwendungen[Bearbeiten | Quelltext bearbeiten]
Baustein in pharmakologisch aktiven Wirkstoffen[Bearbeiten | Quelltext bearbeiten]
Das viergliedrige Lactam-Ringsystem des 2-Azetidinons ist ein gemeinsames Strukturmerkmal einer Reihe von β-Lactam-Antibiotika, wie z. B. der Penicilline, Cephalosporine, und Carbapeneme, der β-Lactamase-Inhibitoren Sulbactam, Tazobactam und Clavulansäure und der nicht-anellierten Monobactame Aztreonam, Tigemonam und Carumonam. Azetidin-2-on selbst besitzt keine antibiotische Aktivität.[1]
Das 2-Azetidinon-Grundgerüst findet sich außerdem in dem Cholesterin-Aufnahmehemmer Ezetimib und in zahlreichen experimentellen Wirkstoffen, z. B. Trypsin- oder Thrombin-Enzyminhibitoren, Antidiabetika, Analgetika, Vasopressin-Antagonisten oder Parkinsonmitteln.[11]
Monomer für Poly-(β-Alanin)[Bearbeiten | Quelltext bearbeiten]
Die anionische ringöffnende Polymerisation (ROP) von 2-Azetidinon liefert hochmolekulares Poly-(β-Alanin), das durch Polykondensation von β-Alanin nicht erhalten werden kann.[6]
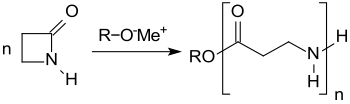
Im Gegensatz zu dem aus siebengliedrigem ε-Caprolactam durch ROP zugänglichen Polyamid 6 schmilzt das auch als Polyamid 3 oder Nylon 3 bezeichnete Poly-(β-Alanin) erst bei Temperaturen oberhalb von 340 °C unter erheblicher Zersetzung und kann daher nicht thermoplastisch verarbeitet werden. Aus Lösung in Ameisensäure kann Poly-(β-Alanin) zu Filmen und Fasern verarbeitet werden, die bisher noch keine technische Verwendung gefunden haben.[6] Die immobilisierte Lipase aus Candida antarctica (CALB) katalysiert die ROP von 2-Azetidinon in Toluol, wobei allerdings nur mittlere Polymerisationsgrade DP von 8 erreicht werden.[10] 2-Azetidinon ist wegen seiner vergleichsweise aufwendigen Herstellung und der eingeschränkten Gebrauchsfähigkeit des polymeren Nylon 3 von geringem praktischem Interesse.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g R.W. Holley, A.D. Holley: 2-Azetidinone (β-Propiolactam). In: J. Am. Chem. Soc. Band 71, Nr. 6, 1949, S. 2129–2131, doi:10.1021/ja01174a062.
- ↑ a b c d e Datenblatt 2-Azetidinone bei Sigma-Aldrich, abgerufen am 5. Februar 2019 (PDF).
- ↑ Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Amsterdam, NL 2014, ISBN 978-0-323-28659-6, S. 268.
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2016, ISBN 978-1-4987-5429-3, S. 3–32.
- ↑ U. Holzgrebe: Struktur-Wirkungs-Beziehungen, Von Penicillin G zu tricyclischen β-Lactamen. In: Pharmazie in unserer Zeit. Band 35, Nr. 5, 2006, S. 410–414, doi:10.1002/200600186.
- ↑ a b c d e H. Bestian: Über Poly-β‐amide. In: Angew. Chem. Band 80, Nr. 8, 1968, S. 304–312, doi:10.1002/ange.19680800803.
- ↑ H. Staudinger: Zur Kenntnis der Ketene. Diphenylketene. In: Liebigs Ann. Chem. Band 356, Nr. 1–2, 1907, S. 51–123, doi:10.1002/jlac.19073560106.
- ↑ K. Clauß, D. Grimm, G. Prossel: β‐Lactame mit über Heteroatome gebundenen Substituenten. In: Liebigs Ann. Chem. Band 1974, Nr. 4, 1974, S. 539–560, doi:10.1002/jlac.197419740403.
- ↑ S.J. Mickel, S.-N Hsiao, M.J. Miller: Synthesis of a key β-lactam intermediate by a [2+2] cycloaddition route: 4-Acetoxyazetidin-2-one In: Organic Syntheses. 65, 1987, S. 135, doi:10.15227/orgsyn.065.0135; Coll. Vol. 8, 1993, S. 3 (PDF).
- ↑ a b c L.W. Schwab, R. Kroon, A.J. Schouten, K. Loos: Enzyme-catalyzed ring-opening polymerization of unsubstituted β‐lactam. In: Macromol. Rapid Commun. Band 29, Nr. 10, 2008, S. 794–797, doi:10.1002/marc.200800117.
- ↑ P.D. Mehta, N.P.S. Sengar, A.K. Pathak: 2-Azetidinone – A new profile of various pharmacological activities. In: Eur. J. Med. Chem. Band 45, 2010, S. 5541–5560, doi:10.1016/ejmech.2010.09.035.
