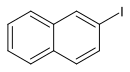
2-Iodnaphthalin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Iodnaphthalin | ||||||||||||||||||
| Summenformel | C10H7I | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 254,07 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt |
54,5 °C[2] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
2-Iodnaphthalin ist eine chemische Verbindung und ein Naphthalin-Derivat.
Synthese[Bearbeiten | Quelltext bearbeiten]
2-Iodnaphthalin wurde erstmals 1881 von P. Jacobson mittels der Sandmeyer-Reaktion aus 2-Aminonaphthalin der Vollständigkeit halber hergestellt, nachdem andere zuvor auf gleiche Weise das 2-Chlor- und das 2-Bromnaphthalin synthetisiert hatten. Er verwendete dabei Iodwasserstoff um das Iod-Atom in die Verbindung einzuführen.[2] J. Schmidlin und M. Huber bemerkten zu der Sandmeyer-Synthese von 2-Iodnaphthalin im Jahr 1910, dass statt der Iodwasserstoffsäure ebenfalls das günstigere Edukt Kaliumiodid eingesetzt werden und mit Schwefelsäure versetzt werden kann, was einer in situ-Erzeugung der Iodwasserstoffsäure entspricht. Weiterhin bemerkte er, dass die Reinigung des Produkts durch Vakuumdestillation leichter durchzuführen ist, als die vormals genutzte Wasserdampfdestillation. Dem Schmelzpunkt nach zu urteilen erhielten die Autoren dadurch ein genauso vergleichbar reines Produkt wie Jacobson nach Umkristallisation und Wasserdampfdestillation des Rohprodukts.[3]
Bis zur Jahrtausendwende wurden in der Literatur keine Syntheserouten veröffentlicht, die gegenüber der Sandmeyer-Reaktion erhebliche Vorteile boten. In der jüngeren Zeit finden sich hingegen einige neue Ansätze. Johnsson et al. zeigte 2005 eine metallkatalysierte Synthese ausgehend von Naphthalin und Iodchlorid. Die Synthese verläuft bei Raumtemperatur in Acetonitril und Dichlormethan als Lösungsmittel. Der Katalysator ist Indiumtriflat und es wurde in einem niedrig-skaligen Testansatz 50 mol% davon benötigt. Zur Aufarbeitung wird die Reaktionslösung nach 12 Stunden mit Triethylamin neutralisiert und restliches Iodchlorid durch Zugabe von Natriumthiosulfat reduziert.[4]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Datenblatt 2-Iodonaphthalene bei Sigma-Aldrich, abgerufen am 5. März 2022 (PDF).
- ↑ a b c d e f P. Jacobson: Ueber einige Verbindungen der β-Reihe des Naphthalins. In: Chem. Ber. Band 14, 1881, S. 803–807, doi:10.1002/cber.188101401172.
- ↑ a b c J. Schmidlin, M. Huber: Dinaphthyl-methan und Naphthofluoren. In: Chem. Ber. Band 33, 1910, S. 2824–2837, doi:10.1002/cber.19100430341.
- ↑ R. Johnsson, A. Meijer, U. Ellervik: Mild and efficient direct aromatic iodination. In: Tetrahedron. Band 61, Nr. 49, 2005, S. 11657–11663, doi:10.1016/j.tet.2005.09.051.

