3,6-Diaminodurol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3,6-Diaminodurol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H16N2 | ||||||||||||||||||
| Kurzbeschreibung |
beiges Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 164,25 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in heißem Wasser und Pyridin[3], in Chlorbenzol[4], Dimethylformamid (DMF),[5] Dimethylacetamid (DMAc)[6] und in N-Methylpyrrolidon (NMP)[7] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
3,6-Diaminodurol (DAD) ist ein Durolderivat, bei dem die Wasserstoffatome in para- bzw. 1,4-Stellung durch Aminogruppen ersetzt sind. Das aromatische Diamin findet Verwendung als Ausgangsstoff für Durochinon und als Monomer für Polyamide, Polyurethane und insbesondere für Polyimide.
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
3,6-Diaminodurol ist in einer Publikation von J.U. Nef aus dem Jahr 1885[8] erstmals beschrieben und 1895 charakterisiert worden.[9] Die Synthese von DAD geht aus von Durol (1,2,4,5-Tetramethylbenzol), das zunächst mit Salpetersäure bzw. Nitriersäure[10] zum 1,4-Dinitrodurol nitriert wird. Die Reduktion zum Diamin erfolgt mittels Zinkstaub und Eisessig[8][9] oder im industriellen Maßstab durch katalytische Hydrierung mit Wasserstoff und Raney-Nickel.[3][4]

Eigenschaften[Bearbeiten | Quelltext bearbeiten]
3,6-Diaminodurol ist ein oxidationsempfindlicher, kristalliner Feststoff, der „in völlig farblosen, glänzenden Tafeln krystallisirt, die sich an der Luft schnell röthlich färben“.[8] Die Verbindung löst sich in Chlorbenzol und Pyridin, sowie in dipolar aprotischen Lösungsmitteln, wie z. B. DMAc und NMP. Beim Umkristallisieren aus heißem Wasser fällt die Substanz in weißen Nadeln aus.[9]
Anwendungen[Bearbeiten | Quelltext bearbeiten]
3,6-Diaminodurol wird (neben anderen Benzochinonen) als Modellsubstanz in Experimenten zum Elektronentransport bei der Photosynthese verwendet.[11]
Bei der Oxidation von 3,6-Diaminodurol mit Eisen(III)-chlorid (FeCl3) entsteht Durochinon (2,3,5,6-Tetramethyl-1,4-benzochinon),[8][10]

das als mildes Oxidationsmittel, besonders bei Untersuchungen von physiologischen Redoxreaktionen, Verwendung findet.[12]
3,6-Diaminodurol wurde als Monomer in stäbchenförmigen aromatischen Polyamiden untersucht, die im Gegensatz zu Aramiden in polaren organischen Lösungsmitteln amorph löslich sind, also keine lyotrope flüssigkristalline Lösungen bilden.[13]
Nach Überführung des 3,6-Diaminodurols mit Phosgen in das Diisocyanat[4] sind durch Reaktion mit Polyolen Polyurethane zugänglich.[14]
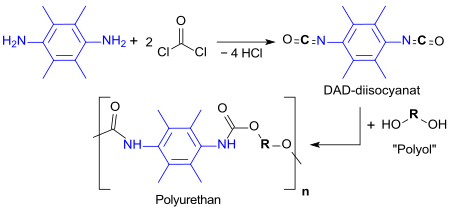
Die wichtigste technische Anwendung für 3,6-Diaminodurol liegt in Polyimiden durch Polyreaktion mit intramolekularen Dianhydriden aus Dicarbonsäuren. Zunächst entsteht in einer Polymerisationsreaktion eine so genanntes Polyamidsäure, die in einem separaten Prozessschritt unter Wasserabspaltung zum Polyimid cyclisiert.
Wichtigster Vertreter der mit 3,6-Diaminodurol gebildeten Polyimid-Homopolymeren (und Copolymeren) ist das so genannte 6FDA-Duren mit 4,4′-(Hexafluorisopropyliden)diphthalsäureanhydrid (6FDA) als Dianhydrid,
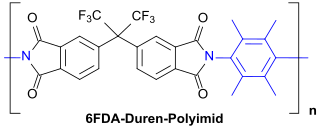
das insbesondere als Material für Gastrennmembranen, z. B. zur Abtrennung so genannter saurer Gase, besonders CO2 und Schwefelwasserstoff H2S aus Erdgas seit Jahren untersucht wird.[7][15][5]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Datenblatt 2,3,5,6-Tetramethyl-p-phenylenediamine bei Sigma-Aldrich, abgerufen am 15. Februar 2022 (PDF).
- ↑ Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 295.
- ↑ a b R. Adams, N.K. Nelson: Restricted rotation in aryl amines. IX. Diaminodurene derivatives. In: J. Amer. Chem. Soc. Band 72, Nr. 1, 1950, S. 132–135, doi:10.1021/ja01157a037.
- ↑ a b c Patent US6486346B1: Process for the preparation of durene diisocyanate. Angemeldet am 14. Dezember 1999, veröffentlicht am 26. November 2002, Anmelder: Bayer AG, Erfinder: P. Heitkämper, K. Jost, S. Penninger.
- ↑ a b M. Li, Z. Zheng, Z. Zhang, N. Li, S. Liu, Z. Chi, J. Xu, Y. Zhang: “All polyimide” mixed matrix membranes for high performance gas separation. In: Polymers. Band 13, Nr. 8, 2021, S. 1329, doi:10.3390/polym13081329.
- ↑ I. Kammakakam, S.Y. Nam, T.-H. Kim: Ionic group-mediated crosslinked polyimide membranes for enhanced CO2 separation. In: RSC Adv. Band 5, Nr. 86, 2015, S. 69907–69914, doi:10.1039/C5RA13081F.
- ↑ a b Patent US5413852: SIXEFTM-durene polyimide hollow fibers. Angemeldet am 1. August 1991, veröffentlicht am 9. Mai 1995, Anmelder: Hoechst Celanese Corp., Erfinder: T.-S. Chung, E.R. Kafchinski, R.H. Vora.
- ↑ a b c d J.U. Nef: Ueber einige Derivate des Durols. In: Chem. Ber. Band 18, Nr. 2, 1885, S. 2801–2807, doi:10.1002/cber.188501802190.
- ↑ a b c J.C. Cain: Zur Kenntnis der Verseifbarkeit aromatischer Nitrile. In: Chem. Ber. Band 28, Nr. 1, 1895, S. 967–969, doi:10.1002/cber.189502801210.
- ↑ a b L.I. Smith: Duroquinone In: Organic Syntheses. 10, 1930, S. 45, doi:10.15227/orgsyn.010.0040; Coll. Vol. 2, 1943, S. 254 (PDF).
- ↑ G. Sarojini, H. Daniell: Site of action of 2,5-dimethoxy-3,6-dichloro-/p-benzoquinone in the photosynthetic electron transport chain. In: Z. Naturforsch. 36c, 1981, S. 656–661, doi:10.1515/znc-1981-7-825.
- ↑ Z. Liu, R.J. Deeth, J.S. Butler, A. Habtemariam, M.E. Newton, P.J. Sadler: Reduction of quinones by NADH catalyzed by organoiridium complexes. In: Angew. Chem. Band 125, Nr. 15, 2013, S. 4288–4291, doi:10.1002/ange.201300747.
- ↑ G.G. Barclay: Rigid-rod aramids incorporating polymethylated monomers. In: J. Mater. Chem. Band 6, Nr. 6, 1996, S. 905–910, doi:10.1039/JM9960600906.
- ↑ Patent US6784219B2: Polyurethane cast elastomers based on durene diisocyanate. Angemeldet am 15. Januar 2000, veröffentlicht am 31. August 2004, Anmelder: Bayer AG, Erfinder: P. Heitkämper, K. Jost, E. Mayer, T. Münzmay, J. Wagner, C. Wolfrum.
- ↑ N. Jusoh, Y.F. Yeong, K.K. Lau, A. Shariff: Enhanced gas separation performance using mixed matrix membranes containing zeolite T and 6FDA-durene polyimide. In: J. Membr. Sci. Band 525, Nr. 3, 2016, S. 175–183, doi:10.1016/j.memsci.2016.10.044.
