5-Nitrovanillin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 5-Nitrovanillin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H7NO5 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 197,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,4500 (25 °C, 589 nm)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
5-Nitrovanillin (4-Hydroxy-3-methoxy-5-nitrobenzaldehyd) ist ein Derivat des Vanillins, das in 5-Stellung eine Nitrogruppe trägt. Wegen der vielen reaktiven funktionellen Gruppen – neben der Nitrogruppe liegt eine Hydroxygruppe, eine Methoxygruppe und eine Aldehydgruppe vor – eignet sich 5-Nitrovanillin als Ausgangsstoff für Phenylethylamine, für Coenzym Q und für die gegen Parkinson-Krankheit wirksamen Hemmstoffe der Catechol-O-Methyltransferase (COMT-Hemmer).
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
5-Nitrovanillin wird bei der Nitrierung von Vanillin mit konzentrierter Salpetersäure in Eisessig in einer Ausbeute von 75 % erhalten.[4]

Mit Acetylnitrat als Nitrierungsagens werden in Gegenwart von Kieselgel Ausbeuten bis 88 % erzielt.[5]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
5-Nitrovanillin ist ein gelber, kristalliner Feststoff von charakteristischem Geruch, der in Wasser sehr wenig löslich, in Alkalilaugen beim Erhitzen und in Methanol gut löslich ist. Beim Umkristallisieren aus Essigsäure fällt die Substanz als hellgelbe Tafeln, aus Ethanol als Nadeln aus.[4]
Anwendungen[Bearbeiten | Quelltext bearbeiten]
5-Nitrovanillin wurde als gelbes Haarfärbemittel in Kombination mit anderen Nitrobenzolfarbstoffen für beständige blonde bis braune Farbtöne patentiert.[6]
Wegen der geringen Löslichkeit von 5-Nitrovanillin in Wasser wird zur Methylierung das gut wasserlösliche Kaliumsalz mit Dimethylsulfat zu 3,4-Dimethoxy-5-nitrobenzaldehyd (5-Nitroveratraldehyd) (22027-96-9) in 91 % Ausbeute umgesetzt.[4]

Bei frühen Arbeiten über psychoaktive Phenylethylamine[4] wurde 3,4-Dimethoxy-5-nitrobenzaldehyd in einer Knoevenagel-Reaktion mit Nitromethan zum entsprechenden Nitrostyrol kondensiert, das elektrochemisch unter Reduktion beider Nitrogruppen zum entsprechenden β-Phenylethylamin reagiert.

Ein wichtiges Zwischenprodukt für die chemische Synthese von Coenzym Q ist 2,3-Dimethoxy-5-methyl-1,4-benzochinon[7], das in einer vierstufigen Synthese aus 5-Nitrovanillin über 3,4-Dimethoxy-5-nitrobenzaldehyd zugänglich ist.[8]
Demethylierung von 5-Nitrovanillin durch Etherspaltung mittels Bromwasserstoffsäure HBr[9] oder mittels Lithiumhydroxid LiOH und Thiophenol in NMP[10] führt zu 3,4-Dihydroxy-5-nitrobenzaldehyd (DHNB).[11],

der als Wirkstoff zur Behandlung von Hyperurikämie und Gicht diskutiert wird.[12]
Größere Bedeutung hat 3,4-Dihydroxy-5-nitrobenzaldehyd (DHNB) als Vorstufe zur Synthese des COMT-Hemmers Entacapon zur Behandlung der Parkinson-Krankheit[13] erlangt. In einer neueren Patentanmeldung wird eine Syntheseroute für den seit 2016 in der EU zugelassenen Wirkstoff Opicapon beschrieben, bei der eingangs 5-Nitrovanillin mit Hydroxylaminhydrochlorid in Dimethylsulfoxid DMSO direkt zum entsprechenden Nitril umgesetzt wird.[14]
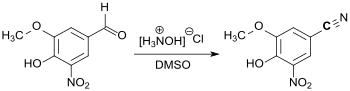
Das erhaltene Nitril reagiert mit einem Hydroxamsäurechlorid zu einem in 3- und 5-Stellung substituierten 1,2,4-Oxadiazol als weitere Zwischenstufe.
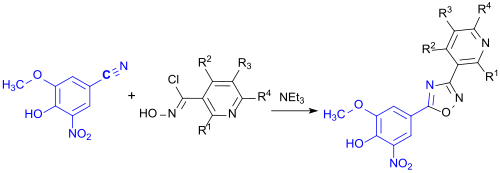
Mit Hydraziden bildet der Aldehyd 5-Nitrovanillin Hydrazone, die mit Chloramin T zu substituierten 1,3,4-Oxadiazolen cyclisiert werden können.[15]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Datenblatt 5-Nitrovanillin, 97 % bei Sigma-Aldrich, abgerufen am 25. Januar 2022 (PDF).
- ↑ a b c Eintrag zu 5-Nitrovanillin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Februar 2023. (JavaScript erforderlich)
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 293.
- ↑ a b c d K.H. Slotta, G. Szyszka: Über β-Phenyläthylamine. IV. Mitteil.: Darstellung von β-[Amino-phenyl]-äthylaminen. In: Chem. Ber. Band 68, Nr. 1, 1935, S. 184–192, doi:10.1002/cber.19350680140.
- ↑ J.A.R. Rodrigues, A.P. de Oliveira Filho, P.J.S. Moran, R. Custódio: Regioselectivity of the nitration of phenol by acetyl nitrate adsorbed on silica gel. In: Tetrahedron. Band 55, Nr. 22, 1999, S. 6733–6738, doi:10.1016/S0040-4020(99)00320-8.
- ↑ Patent US4668237: Dye composition containing 5-nitrovanillin and its use for dyeing keratinic fibres, especially human hair. Angemeldet am 23. Dezember 1985, veröffentlicht am 26. Mai 1987, Anmelder: L’Oréal, Erfinder: J.F. Grollier, J. Cotteret, G. Rosenbaum.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu ubiquinone-0: CAS-Nummer: 605-94-7, EG-Nummer: 210-100-8, ECHA-InfoCard: 100.009.183, PubChem: 69068, ChemSpider: 62289, Wikidata: Q27103400.
- ↑ K. Sato, S. Inoue, H. Sato: The synthesis of 2,3-dimethoxy-5-methyl-p-benzoquinone. In: Bull. Chem. Soc. Jpn. Band 45, Nr. 11, 1972, S. 3455–3457, doi:10.1246/bcsj.45.3455.
- ↑ Patent US4963590: Pharmacologically active compounds, methods for the preparation thereof and compositions containing the same. Angemeldet am 27. November 1987, veröffentlicht am 16. Oktober 1990, Anmelder: Orion-yhtymä Oy, Erfinder: R.J. Bäckström et al..
- ↑ Patent EP0589948B1: Method for the preparation of 3,4-dihydroxy-5-nitrobenzaldehyde. Angemeldet am 18. Juni 1992, veröffentlicht am 4. September 1996, Anmelder: Orion-yhtymä Oy, Erfinder: E. Honkanen, S. Lindholm.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 3-Nitro-4,5-dihydroxybenzaldehyde: CAS-Nummer: 116313-85-0, EG-Nummer: 441-810-8, GESTIS-Stoffdatenbank: 536055, PubChem: 5748957, Wikidata: Q72494658.
- ↑ J.-M. Lü, Q. Yao, C. Chen: 3,4-Dihydroxy-5-nitrobenzaldehyde (DHNB) is a potent inhibitor of xanthine oxygenase: A potential therapeutic agent for treatment of hyperuricemia and gout. In: Biochem. Pharmacol. Band 86, Nr. 9, 2013, S. 1328–1337, doi:10.1016/j.bcp.2013.08.011.
- ↑ A.-N. El-Shorbagi, S. Chaudhury, K.A. Alshenali, R.F. Alabdulrazzaq, F.Y. Alqahtani: A comprehensive review on management of Parkinson’s disease, inclusive of drug discovery and pharmacological approaches. In: J. Appl. Pharm. Sci. Band 10, Nr. 10, 2020, S. 130–150, doi:10.7324/JAPS.2020.1010015.
- ↑ Patent EP3421456A1: New route of synthesis for Opicapone. Angemeldet am 21. Juni 2018, veröffentlicht am 2. Januar 2019, Anmelder: AZAD Pharmaceutical Ingredients AG, Erfinder: C. Frech Nabold, C. Aebersold, G. Grieco, R. Gerber Aeschbacher.
- ↑ Y. Malghe, V.V. Thorat, A.S. Chowdhary, A.S. Bobade: Synthesis, characterization and biological activities of new bis-1,3,4-oxadiazoles. In: J. Chem. Pharm. Res. Band 7, Nr. 6, 2015, S. 392–398.
