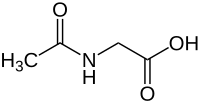
Acetamidoessigsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Acetamidoessigsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C4H7NO3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 117,04 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
3,67 (25 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Acetamidoessigsäure ist eine chemische Verbindung und ein Derivat der Aminosäure Glycin. Die englische Bezeichnung aceturic acid (Acetursäure) findet sich auch in der deutschen Literatur des 19. Jhdts., ist aber heute eher ungebräuchlich. Allerdings werden die Salze der Acetoamidoessigsäure auch als Aceturate bezeichnet. Die Struktur der Verbindung ist durch die systematische Bezeichnung N-Acetylglycin leichter verständlich.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
1884 synthetisierte Theodor Curtius Acetamidoessigsäure durch die Reaktion von Glycin mit Acetanhydrid in Benzol.[3] Die Reaktion kann nach Radenhausen auch lösungsmittelfrei durchgeführt werden. Die Reaktionsenthalpie kann dann allerdings schlechter abgeführt werden.[4] Wie Dakin 1929 beschrieb kann statt Benzol als Lösungsmittel auch Essigsäure verwendet werden. Das Produkt kristallisiert aus der Reaktionslösung bei Kühlen aus. Nach dem Filtern und Waschen mit Wasser und Diethylether wird ein ausreichend reines Produkt erhalten.[5]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Acetamidoessigsäure hat die Eigenschaft, mit Aldehyden in einer Lösung aus wasserfreiem Natriumacetat in Essigsäure Oxazolidinon-Ringe zu bilden, welche oft eine gelbe Farbe haben. Dabei handelt es sich um eine Cyclokondensation (Wasser wird frei):[5]

Siehe auch[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Datenblatt N-Acetylglycin bei Sigma-Aldrich, abgerufen am 20. Mai 2022 (PDF).
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-88.
- ↑ Th. Curtius: Ueber Acetursäure (Acetylglycin). In: Chemische Berichte. Band 17, Nr. 2, S. 1664–1674, doi:10.1002/cber.18840170226.
- ↑ Th. Curtius, R. Radenhausen: Hydrazide und Azide organischer Säuren. X Abhandlung. 35. Ueber Hydrazide substituirter Amidosäuren und das Hydrazid der Fumarsäure. In: Journal für Praktische Chemie. Band 52, Nr. 1, 1895, S. 433–454, doi:10.1002/prac.18950520134.
- ↑ a b H. D. Dakin: The condensation of aromatic aldehydes with glycine and acetylglycine. In: Journal of Biological Chemistry. Band 82, Nr. 2, 1929, S. 439–446, doi:10.1016/S0021-9258(20)78291-8.