Aluminiumbromid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
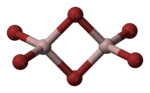
| |||||||||||||||||||
| Dimer des Aluminiumbromids: _ Al3+ _ Br− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Aluminiumbromid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | AlBr3 | ||||||||||||||||||
| Kurzbeschreibung |
glänzende, farblose Blättchen[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 266,69 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
3,2 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−516 kJ·mol−1[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Aluminiumbromid ist eine anorganische chemische Verbindung aus Brom und Aluminium mit der Summenformel AlBr3.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Aluminiumbromid kann durch Überleiten von Bromdampf über ein glühendes Gemisch aus Kohlenstoff und Aluminiumoxid oder durch die direkte Einwirkung von Brom auf Aluminium synthetisiert werden[6].
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Die molare Masse beträgt 266,69 g/mol, seine Dichte 3,2 g/cm³. Es hat einen Schmelzpunkt von 97,5 °C und einen Siedepunkt von 263 °C.
Im festen Zustand bildet Aluminiumbromid Al2Br6-Moleküle[1], in denen zwei Bromidionen als Brückenliganden auftreten, was dazu führt, dass das Aluminiumatom ein Elektronenoktett erreicht.
Aluminiumbromid ist in Benzol, Toluol, Schwefelkohlenstoff und vielen weiteren organischen Lösungsmitteln löslich.[6] Es bildet farblose rhombische und an feuchter Luft rauchende Kristalle. Es besitzt eine monokline Kristallstruktur, Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3), a = 1030,82 pm, b = 710,12 pm, c = 753,64 pm, β = 96,418°.[7]
Aluminiumbromid reagiert unter Bildung einer stark sauren Lösung unter heftiger Reaktion mit Wasser.[1] Hierbei werden die Al-Br-Bindungen weitgehend hydrolysiert. Aus der Lösung kristallisiert Aluminiumbromid als Hexahydrat AlBr3 · 6 H2O.
Verwendung[Bearbeiten | Quelltext bearbeiten]
Die Hauptverwendung von Aluminiumbromid ist als Katalysator bei organischen Synthesen, wie beispielsweise der Polymerisation, den Friedel-Crafts-Reaktionen oder der Bromierung.[1]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Eintrag zu Aluminiumbromid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- ↑ a b c Datenblatt Aluminiumbromid bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b c d Eintrag zu Aluminiumbromid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b Yoffe, D.; Frim, R.; Ukeles, S.D.; Dagani, M.J.; Barda, H.J.; Benya, T.J.; Sanders, D.C.: Bromine Compounds, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2013; doi:10.1002/14356007.a04_405.pub2.
- ↑ PAETEC Formelsammlung Ausgabe 2003, Seite 116.
- ↑ a b Douglas G. Nicholson et al.: Aluminium bromide. In: Ludwig F. Audrieth (Hrsg.): Inorganic Syntheses. Band 3. McGraw-Hill, Inc., 1950, S. 30–36 (englisch).
- ↑ R.W. Berg, F.W. Poulsen, K. Nielsen: Redetermination of the crystal structure of Al2Br6. A comparison of three methods. In: Acta Chemica Scandinavica. 1997, 51, S. 442–448. doi:10.3891/acta.chem.scand.51-0442.


