Bariumoxalat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
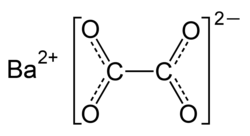
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bariumoxalat | |||||||||||||||
| Summenformel | BaC2O4 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 225,35 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
2,658 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Bariumoxalat ist eine chemische Verbindung des Bariums aus der Gruppe der Oxalate.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Bariumoxalat kann durch Reaktion von Bariumchlorid mit Oxalsäurelösung oder Ammoniumoxalat gewonnen werden.[5]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Bariumoxalat und sein Monohydrat sind weiße, geruchlose Feststoffe, die praktisch unlöslich in Wasser sind.[1][2] Das Monohydrat wandelt sich bei 140 bis 150 °C in das Anhydrat um.[3]
Das Dihydrat hat eine monokline Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14).[6] Das Monohydrat und das 3,5-Hydrat haben eine monokline Kristallstruktur mit der Raumgruppe C2/m (Nr. 12) bzw. C2/c (Nr. 15).[7][8] Das Hemihydrat und das α-Anhydrat haben eine trikline Kristallstruktur mit der Raumgruppe P1 (Nr. 2).[9]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Bariumoxalat-monohydrat wird in der Pyrotechnik und als Analysereagenz verwendet.[10]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, 2015, ISBN 978-1-4822-6097-7, S. 50 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e f g h Datenblatt Bariumoxalat bei Alfa Aesar, abgerufen am 1. April 2022 (Seite nicht mehr abrufbar).
- ↑ a b P. H. List, L. Hörhammer: Chemikalien und Drogen (Am – Ch). Springer-Verlag, 2013, ISBN 978-3-642-80562-2, S. 365 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter die Gruppeneinträge zu barium salts, with the exception of barium sulphate, salts of 1-azo-2-hydroxynaphthalenyl aryl sulphonic acid, and of salts specified elsewhere in this Annex und salts of oxalic acid with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 18. März 2017. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Wilhelm Hurka: Chemisches Praktikum für Mediziner. Springer-Verlag, 2013, ISBN 978-3-662-02242-9, S. 32 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. Nørl und Christensen, R.G. Hazell, A.M.T. Bell, A. Altomare: Precision of a crystal structure derived from a synchrotron X-ray powder pattern. The structure of Barium oxalate hydrate, BaC2O4-2H2O. In: Journal of Physics and Chemistry of Solids. 56, 1995, S. 1359, doi:10.1016/0022-3697(95)00070-4.
- ↑ R. Neder, M. Burghammer, H. Schulz, A. N. Christensen, H. G. Krane, A. M. T. Bell, A. W. Hewat, A. Altomare: Crystal structure determination of barium Oxalate, BaC2O4 - 3.5 H2O/D2O. In: Zeitschrift für Kristallographie - Crystalline Materials. 212, 1997, doi:10.1524/zkri.1997.212.4.305.
- ↑ Huang Sheng-hua, Thomas C. W. Mak: Refinement of the crystal structure of barium Oxalate monohydrate. In: Zeitschrift für Kristallographie - Crystalline Materials. 190, 1990, doi:10.1524/zkri.1990.190.3-4.305.
- ↑ Axel Nørlund Christensen, Rita Grønbæk Hazell, Ian Charles Madsen: Synthesis and characterization of the barium oxalates BaC2O4-0.5H2O, α-BaC2O4 and β-BaC2O4. In: Acta Crystallographica Section B Structural Science. 58, 2002, S. 808, doi:10.1107/S0108768101020717.
- ↑ Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2011, ISBN 978-1-4398-1462-8, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).


